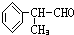题目内容
银镜反应是检验醛基的重要反应,教材对该实验的操作条件只是粗略的描述.某同学进行如下研究:(1)在干净试管中加入2ml 2%
(2)依次滴加2%、5%、10%、20%、40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中.3分钟后,试管1#未形成大面积银镜,试管5#的银镜质量差有黑斑,试管4#产生的银镜质量一般,试管2#、3#形成光亮的银镜.该研究的目的是:
(3)乙醛发生银镜反应的化学方程式为:
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜.验证和对比实验如下.
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 |
实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和 数滴浓氨水 |
有气泡产生:一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3?H2O b.AgOH不稳定,极易分解为黑色Ag2O
经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.产生Ag2O的原因是:
(5)用湿润的红色石蕊试纸检验NH3产生的现象是
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O.如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为:
(2)此实验为对比实验,其它条件一致,乙醛溶液的用量不一样,生成银镜的质量不同.故实验的目的是:探究银镜反应实验中,乙醛溶液的浓度与现象的关系;
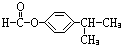
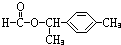
(3)银镜反应的方程式书写:CH3CHO+2[Ag(NH3)2]OH
| 水浴 |
(4)在NaOH存在下,NH3?H2O受热分解成NH3逸出,促使平衡Ag(NH3)2++2H2O?Ag++2NH3?H2O正向移动,c(Ag+)增大,Ag+与OH-反应应生成AgOH,AgOH不稳定分解为Ag2O;
(5)氨气溶于水生成NH3?H2O,NH3?H2O电离,有OH-生成,溶液显碱性,能使红色石蕊试纸变蓝;Ag和稀HNO3反应方程式为:4HNO3(稀)+3Ag=3AgNO3+NO↑+2H2O;
(6)由实验ⅠⅡ知:在强碱性条件下,没有醛基化合物,银氨溶液本身也能形成银镜,在弱碱条件下,没有含醛基的化合物,银氨溶液本身不能形成银镜.
故答案为:AgNO3溶液;逐滴加入稀氨水,直到最初产生的白色沉淀消失为止;
(2)此实验为对比实验,其它条件一致,乙醛溶液的用量不一样,生成银镜的质量不同.故实验的目的是:探究银镜反应实验中,乙醛溶液的浓度与现象的关系,
故答案为:探究银镜反应实验中,乙醛溶液的浓度与现象的关系;
(3)银镜反应的方程式书写,配平:1mol-CHO和2molAg(NH3)2OH反应,反应的方程式为CH3CHO+2[Ag(NH3)2]OH
| 水浴 |
故答案为:CH3CHO+2[Ag(NH3)2]OH
| 水浴 |
(4)在NaOH存在下,NH3?H2O受热分解成NH3逸出,促使平衡Ag(NH3)2++2H2O?Ag++2NH3?H2O正向移动,c(Ag+)增大,Ag+与OH-反应应生成AgOH,AgOH不稳定分解为Ag2O,
故答案为:在NaOH存在下,加热使NH3逸出,促使平衡Ag(NH3)2++2H2O?Ag++2NH3?H2O正向移动,c(Ag+)增大,Ag+与OH-反应立即转化为Ag2O;
(5)氨气溶于水生成NH3?H2O,NH3?H2O电离,有OH-生成,溶液显碱性,能使红色石蕊试纸变蓝;Ag和稀HNO3反应方程式为:4HNO3(稀)+3Ag=3AgNO3+NO↑+2H2O,
故答案为:试纸变蓝; 4HNO3(稀)+3Ag=3AgNO3+NO↑+2H2O;
(6)由实验ⅠⅡ知:在强碱性条件下,没有醛基化合物,银氨溶液本身也能形成银镜,在弱碱条件下,没有含醛基的化合物,银氨溶液本身不能形成银镜.故答案为:在强碱性条件下,银氨溶液本身也能形成银镜,无须含醛基化合物.

银镜反应是检验醛基的重要反应,教材对该实验的操作条件只是粗略的描述。某同学进行如下研究:
(1)在干净试管中加入2ml2% ,然后, 得到银氨溶液,分装入5支试管,编号为1#.2#.3#.4#.5# 。
(2)依次滴加2%.5%.10%.20%.40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中。3分钟后,试管1#未形成大面积银镜,试管5# 的银镜质量差有黑斑, 试管4# 产生的银镜质量一般,试管2#.3# 形成光亮的银镜。
该研究的目的是: 。
(3)乙醛发生银镜反应的化学方程式为: ,
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜。验证和对比实验如下。
|
装置 |
实验序号 |
试管中的药品 |
现象 |
|
|
实验Ⅰ |
2mL银氨溶液和数滴较浓NaOH溶液 |
有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
|
实验Ⅱ |
2mL银氨溶液和 数滴浓氨水 |
有气泡产生:一段时间后,溶液无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料后,得知:
a.Ag(NH3)2++2H2O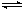 Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。产生Ag2O的原因是:
。
(5)用湿润的红色石蕊试纸检验NH3产生的现象是 。用稀HNO3清 洗试管壁上的Ag,该反应的化学方程式是 。
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O。如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为: