题目内容
| 实验 序号 |
碳酸钙 状态 |
c(HCl) /mol?L-1 |
溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
(1)本反应属于
(2)实验6和7表明,
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是
(4)本实验中影响反应速率的其它因素还有
反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:放热;CaCO3+2H+=Ca2++CO2↑+H2O;
(2)由实验6和7、8和9的实验数据可知,温度越高,碳酸钙消失的时间越少,说明温度越高,反应速率越大,
故答案为:温度;温度越高;8和9;
(3)实验1、3、4、6、8相同的地方是固体的形状相同,反应前的温度相同,但反应物的浓度依次增大,碳酸钙消失的时间以此减少,说明反应物浓度越大,反应速率越快,
故答案为:反应物浓度越大,反应速率越快;
(4)1、2与4、5两组数据反应温度相同,盐酸的浓度相同,但固体的形状不同,实验数据标明粉末时的反应速率大于粒状,则可说明接触面积越大,反应速率越大,
故答案为:接触面积;4和5.

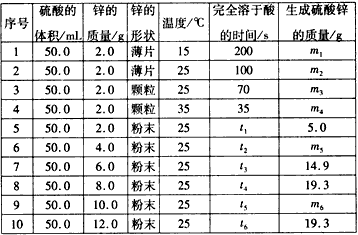
分析以下数据,回答下列问题:
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| 2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| 4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| 5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| 6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| 7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| 8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| 9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| 10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
(2)下列说法正确的是
A.t1<70 B.m1<m2 C.m6=19.3 D.t1>t4
(3)本实验还可以研究
(4)硫酸的物质的量浓度是
①写出该反应的化学方程式:___________________________________________________;
②上述反应中生成0.1 mol还原产物时,转移电子的物质的量是_________________mol;
③由单质与氧气反应生成
(2)控制变量是科学研究中的重要研究方法,其基本思路是,在实验研究中人为只改变一个因素(调节变量),其他因素保持相同,观察测定因调节变量改变而改变的因素(因变量),从而分析得到研究结论。中学化学中应用控制变量的方法研究问题的例子很多。请分析或设计:
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4![]() Na2SO4+S↓+SO2↑+H2O)。
Na2SO4+S↓+SO2↑+H2O)。
烧杯编号 | 加3%Na2S2O3溶液体积(mL) | 加H2O体积(mL) | 加(体积比为1∶20)H2SO4溶液体积(mL) | 所需时间(s) |
1 | 5 | 5 | 2 |
|
2 | 7 | 3 | 2 |
|
3 | 10 | 0 | 2 |
|
在三个烧杯(底部有黑色“+”字标记)内分别加入表中所示体积的三种液体,搅拌并开始计时,到出现浑浊使烧杯底部“+”字看不见时停止计时。比较所需时间,得出浓度对化学反应速率影响的结论。实验中,温度和反应体系中硫酸浓度是保持相同的因素,调节变量是_________________,因变量是_________________。
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:
__________________________________。
(12分)控制变量法是化学实验的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/ ℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
分析以下数据,回答下列问题:
(1)实验1和实验2表明,______________对反应速率有影响,对同一规律进行研究的实验还有一组是______________________(填实验序号)。
(2)下列说法正确的是_______
A.t1<70 B. m1<m2 C. m6=19.3 D. t1>t4
(3)本实验还可以研究___________________________对化学反应速率的影响。
(4)硫酸的物质的量浓度是______mol/L, 实验6生成的硫酸锌的质量m5=________g。