摘要:室温时.对于0.1mol·L-1的NH3·H2O.则下列说法正确的是 A.该溶液的pH>13 B.加入等体积0.1mol·L-1盐酸后所得溶液的pH=7 C.该溶液的pH=13 D.加入等体积0.1mol·L-1盐酸后所得溶液的pH<7
网址:http://m.1010jiajiao.com/timu3_id_45914[举报]
室温时,若0.1mol?L-1的一元弱碱的电离度为1%,则下列正确的是( )
| A、该溶液的pH=11 | B、该溶液的pH=3 | C、加入等体积0.1 mol?L-1HCl后所得溶液的pH=7 | D、加入等体积0.1 mol?L-1HCl后所得溶液的pH>7 |
(1)室温时,将0.1mol氨气溶于水制成1L溶液,则该溶液的pH为
若在上述溶液中加入稀硫酸,使其恰好完全反应,所得溶液中离子浓度由大到小的顺序为
(2)T=593K,P=2×107Pa的体积百分比为60%的CO及40%的H2是混合物,让其通过活性氧化锌催化剂后,将有一部分转化为甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).已知CO的转化率为16%,则H2的转化率是
查看习题详情和答案>>
11
11
[假设室温时,Kb(NH3?H2O)=1.0×10-5mol?L-1]若在上述溶液中加入稀硫酸,使其恰好完全反应,所得溶液中离子浓度由大到小的顺序为
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
;若向所得溶液中加入少量硫酸铵固体,使溶液的浓度增大,水解程度减小
减小
(填“增大”、“减小”或“不变”).(2)T=593K,P=2×107Pa的体积百分比为60%的CO及40%的H2是混合物,让其通过活性氧化锌催化剂后,将有一部分转化为甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).已知CO的转化率为16%,则H2的转化率是
48%
48%
,若容器的容积不变,此时气体的压强是1.616×107
1.616×107
Pa.在25℃时,对于0.1mol?L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
将
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,此时溶液的pH
(3)若向氨水中加入0.05mol?L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1
查看习题详情和答案>>
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
| c(NH+) | c(NH3?H2O) |
增大
增大
(填“增大”、“减小”或“不变”);(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,此时溶液的pH
小于
小于
7(填“大于”、“小于”或“等于”),用离子方程式表示其原因NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
,此时溶液中各离子浓度由大到小的顺序为 NH3?H2O+H+
NH3?H2O+H+c(NH4+)>c(SO42- )>c(H+)>c(OH-)
c(NH4+)>c(SO42- )>c(H+)>c(OH-)
.(3)若向氨水中加入0.05mol?L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1
大于
大于
V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式c(NH4+)+c(H+)=2c(SO42- )+c(OH-)
c(NH4+)+c(H+)=2c(SO42- )+c(OH-)
.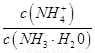 将 (填“增大”、 “减小”或“不变”);
将 (填“增大”、 “减小”或“不变”);