摘要:21.某校化学兴趣小组欲研究一种镁铝合金.以下是部分实验.请完成填空. [实验一]从镁铝合金片上剪下一小块.先称重.然后投到盛有10mL 10mol·L-1NaOH溶液的锥形瓶里. (1)从反应开始至反应结束.依次可观察到的现象有:①切口断面处先产生气泡.反应由慢到快,②小块合金在溶液中上下翻腾,③溶液升温,④反应后.溶液中残留黑色黑体. (2)开始时产生气泡速率慢.其主要原因是 . (3)写出所形成原电池负极的电极反应式: . (4)欲利用此反应测定合金中铝的金属.理论上还应该测定哪些数据?请仿照方法①写出另一种不同方法所需数据. 方法 需测定的数据 ① 测定产生的H2的体积 ② [实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl.使镁.铝两种元素恰好只以氯化物的形式存在.写出此过程中含铝元素的化合物所发生的离子反应方程式: . [实验三]取实验二的锥形瓶里的溶液10mL.向其中商加a mLC1mol·L-1NaOH之后. 改成滴加C2mol·L-1HCl.所得沉淀Y间的关系如图所示. 据此.回答下列问题: (1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体 积的两倍.则C1/C2= , (2)所加入NaOH溶液的体积a= mL.
网址:http://m.1010jiajiao.com/timu3_id_45466[举报]
 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.
某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol?L-1NaOH溶液(足量)的锥形瓶里.
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色黑体.
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是
(3)写出所形成原电池负极的电极反应式:
(4)欲利用此反应测定合金中铝的金属,理论上还应该测定哪些数据?请仿照方法①写出另一种不同方法所需数据.
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
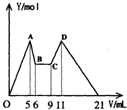
[实验三]取实验二的锥形瓶里的溶液10mL,向其中商加a mLC1mol?L-1NaOH之后,改成滴加C2mol?L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如图所示.据此,回答下列问题:
(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体积的两倍,则C1/C2=
(2)所加入NaOH溶液的体积a=
已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,A焰色呈浅黄色(透过兰色钴玻璃),E为黑色粉末,在下述转化中E均起催化作用(某些产物已略去)(如图1).

请回答:
(1)A的名称为 ;B的结构式为 ;
(2)已知A与某酸(含A中元素M)在一定条件下反应,产生气体单质X(含元素M).X能与液体B反应生成气体D,写出该反应的化学方程式: ;
(3)某校化学兴趣小组为研究X单质的性质,设计如图2所示装置进行实验.装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
①加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处,然后向分液漏斗中加水,打开 ,一段时间后 ,则气密性良好;
②写出装置I中发生反应的离子方程式 ;
③实验过程中,装置Ⅳ中的实验现象为 ;
④实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象.为了达到这一实验目的,你认为应有 之间还需添加洗气瓶(选填装置序号),该装置的作用是 .
查看习题详情和答案>>

请回答:
(1)A的名称为
(2)已知A与某酸(含A中元素M)在一定条件下反应,产生气体单质X(含元素M).X能与液体B反应生成气体D,写出该反应的化学方程式:
(3)某校化学兴趣小组为研究X单质的性质,设计如图2所示装置进行实验.装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
①加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处,然后向分液漏斗中加水,打开
②写出装置I中发生反应的离子方程式
③实验过程中,装置Ⅳ中的实验现象为
④实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象.为了达到这一实验目的,你认为应有
“阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水.某校化学兴趣小组欲探究该“脱氧剂”中Fe粉和活性炭质量之比,设计并进行了如下探究过程,请你参与实验并回答有关问题.
步骤(1)取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末.由此得出的结论为上述“脱氧剂”中的铁已部分被
步骤(2)将步骤(1)中的固体溶于水,过滤,将滤渣洗涤、干燥.该步骤的目的是
步骤(3)取步骤(2)中的滤渣,将其分为两等份,每一份质量为8.0g.将其中一份在氧气流中充分灼烧,生成的气体全部通入足量得澄清石灰水,得到干燥、纯净的沉淀20.0 g.8.0 g滤渣中活性炭的质量为
步骤(4)将步骤(3)中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全.请写出有氢气生成的化学反应方程式
步骤(5)向步骤(4)中的混合物中加入过量的氢氧化钠溶液,过滤得到的固体经洗涤后转移到坩埚中充分加热、灼烧,冷却、称量,得到6.4gFe2O3固体.
结论:该“脱氧剂”中的Fe粉和活性炭质量之比为
查看习题详情和答案>>
步骤(1)取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末.由此得出的结论为上述“脱氧剂”中的铁已部分被
氧化
氧化
;步骤(2)将步骤(1)中的固体溶于水,过滤,将滤渣洗涤、干燥.该步骤的目的是
除去NaCl
除去NaCl
;步骤(3)取步骤(2)中的滤渣,将其分为两等份,每一份质量为8.0g.将其中一份在氧气流中充分灼烧,生成的气体全部通入足量得澄清石灰水,得到干燥、纯净的沉淀20.0 g.8.0 g滤渣中活性炭的质量为
2.4g
2.4g
;步骤(4)将步骤(3)中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全.请写出有氢气生成的化学反应方程式
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
;步骤(5)向步骤(4)中的混合物中加入过量的氢氧化钠溶液,过滤得到的固体经洗涤后转移到坩埚中充分加热、灼烧,冷却、称量,得到6.4gFe2O3固体.
结论:该“脱氧剂”中的Fe粉和活性炭质量之比为
28:15
28:15
. (2012?开封一模)某校化学兴趣小组为研究铜丝与过量浓硫酸的反应及SO2的部分化学性质,进行如下实验.该小组同学在实验中发现使用教材所提供的铜和浓硫酸反应的实验装置不仅安全性差而且易造成环境污染.经过同学们的讨论以及老师的指导,该小组设计了图所示的装置并进行实验.
(2012?开封一模)某校化学兴趣小组为研究铜丝与过量浓硫酸的反应及SO2的部分化学性质,进行如下实验.该小组同学在实验中发现使用教材所提供的铜和浓硫酸反应的实验装置不仅安全性差而且易造成环境污染.经过同学们的讨论以及老师的指导,该小组设计了图所示的装置并进行实验.请回答下列问题:
(1)装置A中发生反应的化学方程式为
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
;
| ||
(2)请写出玻璃导管的作用
防止B中的液体倒吸
防止B中的液体倒吸
(只写一点就可);(3)对试管A进行加热,发现D试管中有气泡逸出,品红溶液很快褪色,但最终未见C试管中氢氧化钡溶液出现浑浊,为探究C试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
| 物质 | 溶解度 | 物质 | 溶解度 |
| Ca(OH)2 | 0.173 | Ba(OH)2 | 3.89 |
| CaCO3 | 0.0013 | BaSO3 | 0.016 |
| Ca(HCO3)2 | 16.60 |
生成了溶解度较大的亚硫酸氢钡
生成了溶解度较大的亚硫酸氢钡
;(4)为验证C试管中溶液的组成,进行了下列实验,请你帮助完成下列实验报告:
| 实验方案 | 现象 |
| 方案1:取少量溶液于试管中,加入稀盐酸,加热,用① 湿润的品红试纸 湿润的品红试纸 检验产生的气体. |
② 试管中有气泡生成,品红试纸褪色 试管中有气泡生成,品红试纸褪色 |
| 方案2:取少量溶液于试管中,加入③ 氢氧化钠 氢氧化钠 溶液并观察现象. |
④ 试管中出现浑浊 试管中出现浑浊 |
溶液由无色恢复为红色
溶液由无色恢复为红色
,该实验可以达到的目的是二氧化硫和有色物质生成的无色物质是不稳定的
二氧化硫和有色物质生成的无色物质是不稳定的
;(6)试管D用于吸收多余的SO2,向吸收SO2后的混合溶液中加少许溴水,振荡后溶液变为无色,写出加溴水后褪色反应的离子方程式.
SO32-+Br2+2OH-=H2O+SO42-+2Br-
SO32-+Br2+2OH-=H2O+SO42-+2Br-
.(10分)某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | |
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、滴管、1 mol·L-1NaOH溶液、1 mol·L-1HCl溶液、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。(可填满、可不填满)
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| …… | |