网址:http://m.1010jiajiao.com/timu3_id_45033[举报]
Ⅰ.化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究.甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应.他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置有些铂丝,反应速率明显加快.此时,其他组的同学提出方案如下:
乙组:Cu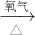 CuO
CuO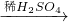 CuSO4
CuSO4
丙组:Cu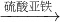 CuSO4
CuSO4
丁组:Cu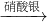 Cu(NO3)2
Cu(NO3)2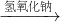 Cu(OH)2
Cu(OH)2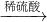 CuSO4
CuSO4
戊组:Cu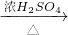 CuSO4
CuSO4
(1)甲组试验可用一个化学反应方程式表示为______;使反应变快的可能原因是______;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的试验操作步骤应为______、______、______,取得产品后的残留物质可循环使用.
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染.则在五组方案中,有科学性错误的是______ 组方案,有污染的是______组方案,无污染但能量消耗较高的是______组方案,因此选择______组方案最好.
Ⅱ.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
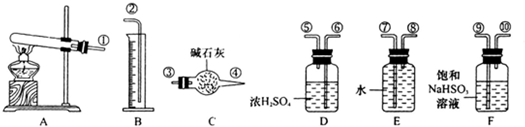
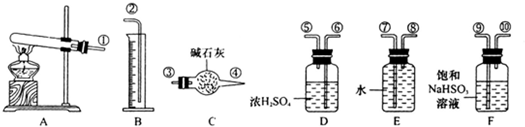
CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示:
试验测得数据及有关结果如下;
①准确称取6.0g无水CuSO4;②在试验结束时干燥管总质量增加2.4g;③测得量筒中水的体积,得出气体在标准状况下的体积为280mL;试验结束时,装置F中的溶液只含NaHSO4和NaHSO3.按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(1)装置F的作用是______.
(2)装置D的作用是______.
(3)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温.
②______,
③______.
(4)通过计算,推断出该条件下反应的化学方程式______.
查看习题详情和答案>>
乙组:Cu
| 氧气 |
| △ |
| 稀H2SO4 |
丙组:Cu
| 硫酸亚铁 |
丁组:Cu
| 硝酸银 |
| 氢氧化钠 |
| 稀硫酸 |
戊组:Cu
| 浓H2SO4 |
| △ |
(1)甲组试验可用一个化学反应方程式表示为
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染.则在五组方案中,有科学性错误的是
Ⅱ.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
CuSO4
| △ |
试验测得数据及有关结果如下;
①准确称取6.0g无水CuSO4;②在试验结束时干燥管总质量增加2.4g;③测得量筒中水的体积,得出气体在标准状况下的体积为280mL;试验结束时,装置F中的溶液只含NaHSO4和NaHSO3.按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(1)装置F的作用是
(2)装置D的作用是
(3)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温.
②
③
(4)通过计算,推断出该条件下反应的化学方程式
| ||
| ||
(1)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
①甲、乙、丙提出的实验方案是否能得到纯净的金属铜?
甲________________,乙_____________,丙________________。(填“能”或“不能”)
②在能制得铜的方案中,哪一步操作会导致环境污染?_________________。应增加哪些措施防止污染?__________________________。
(2)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合利用:

请回答下列问题:
①在图中的括号内填写适当的反应条件。
②Mg(OH)2固体存在如下溶解平衡:
Mg(OH)2(s)![]() Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
③依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203 kg MgCl2·6H2O原料,可以获得29.8 kg MgO、________kg 36.5%的盐酸和________kg MgCl2。
查看习题详情和答案>>乙组:

丙组:

丁组:

戊组:

(1)甲组实验可用一个化学反应方程式表示为___________ ;使反应变快的可能原因是__________ ;从该反应器溶液(含有少量
 以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。
以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。 (2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,__________ 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
 ,便决定设计实验测定反应生成的
,便决定设计实验测定反应生成的 和O2的物质的量,并经计算确定该条件下
和O2的物质的量,并经计算确定该条件下 分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示: 
① 准确称取6.0g无水;
②在试验结束时干燥管总质量增加2.4g;
③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;
试验结束时,装置F中的溶液只含NaHSO4和NaHSO3按装置从左到右的方向,各仪器接口连结顺序为: ①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(3)装置F的作用是__________。
(4)装置D的作用是__________。
(5)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。 ②_____________ , ③________________ 。
(6)通过计算,推断出该条件下反应的化学方程式_______________________。
某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚的兴趣,试通过实验来探究其成分。
Ⅰ.实验装置:
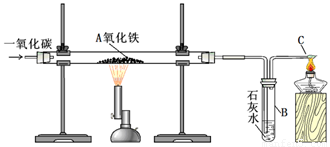
用一氧化碳还原氧化铁的实验装置
该装置B中发生的离子方程式是
装置B的作用是
Ⅱ.实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ.实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,她增加了一个实验:用磁铁靠近生成的黑色固体,看到有黑色固体被磁铁吸引。于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们结论作出判断并通过实验检验其合理性:
(1)在一定条件下:一氧化碳与氧化铁在加热条件下,可发生如下反应
3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+4CO 4Fe+4CO2
4Fe+4CO2
(2)四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论: 你对此评价的理由是:
Ⅳ.实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中__ _____________________
为确定实验中最后的产物的成分,丙同学设计如下实验,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器: 1mol/LCuSO4 、0.01mol/L KSCN溶液、1mol/L盐酸、0.01mol/L氯水、试管、玻璃棒、胶头滴管。
|
实验操作 |
预期现象和结论 |
|
步骤一:取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/LCuSO4溶液、搅拌溶解。 |
(1)若A试管中黑色固体不溶解,并且没有观察到其他现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有Fe。 |
|
步骤二:对试管B中溶液过滤,将所得固体洗涤干净后,加足量1mol/L盐酸后,再依次分别加入适量0.01mol/L氯水、少量0.01mol/L KSCN溶液 |
(1)若溶液不变红色,则
(2)若溶液变红色,则
|
Ⅴ.延伸探究:丁同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应) (填“行”或“不行”)理由是 。
查看习题详情和答案>>