摘要: 下列化学反应中.能产生Al(OH)3沉淀的是 ①AlCl3溶液与过量氨水混合②NaAlO2溶液与过量盐酸混合 ③NaAlO2溶液中通入过量CO2气体④明矾溶液与小苏打溶液混合 A.①② B.①④ C.①③④ D.②③
网址:http://m.1010jiajiao.com/timu3_id_44609[举报]
(10分)图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答:

Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比_______;
Ⅱ.(B处溶液中存在的浓度最大的离子是_____________(填离子符号);
Ⅲ.(铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++AlO2-+H2O=Al(OH)3↓+NH3↑。
试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式: ;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少。请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
(3)向含有0.01mol NH4Al(SO4)2溶液中逐滴加入5mol·L-1NaOH溶液,请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
查看习题详情和答案>>
(10分)图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答:
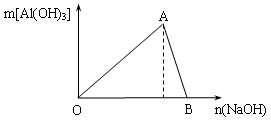
Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比_______;
Ⅱ.(B处溶液中存在的浓度最大的离子是_____________(填离子符号);
Ⅲ.(铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++AlO2-+H2O=Al(OH)3↓+NH3↑。
试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式: ;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少。请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
(3)向含有0.01mol NH4Al(SO4)2溶液中逐滴加入5mol·L-1NaOH溶液,请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。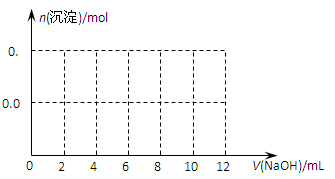

Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比_______;
Ⅱ.(B处溶液中存在的浓度最大的离子是_____________(填离子符号);
Ⅲ.(铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++AlO2-+H2O=Al(OH)3↓+NH3↑。
试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式: ;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少。请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
(3)向含有0.01mol NH4Al(SO4)2溶液中逐滴加入5mol·L-1NaOH溶液,请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业制备无水AlCl3的流程如下:

(1)已知:C(s)+
O2(g)═CO(g)△H=-110.5kJ/mol,2Fe(s)+
O2(g)═Fe2O3(s)△H=-822.1kJ/mol
请写出C还原Fe2O3生成CO的热化学方程式
(2)反应2CO+O2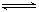 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2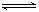 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3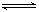 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式
(3)高温下,氧化铁能跟碳发生下列反应:
①Fe2O3+3C
2Fe+3CO ②Fe2O3+3CO
2Fe+3CO2若反应产生的气体是CO2和CO,则
的取值范围是
(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因
(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)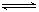 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
①增加C的量 ②多通入Cl2③升高温度 ④移走部分AlCl3(g) ⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5mol/L时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L.此时所得沉淀中
查看习题详情和答案>>

(1)已知:C(s)+
| 1 |
| 2 |
| 3 |
| 2 |
请写出C还原Fe2O3生成CO的热化学方程式
3C(s)+Fe2O3(s)═3CO(g)+2Fe(s)△H=+490.6kJ/mol
3C(s)+Fe2O3(s)═3CO(g)+2Fe(s)△H=+490.6kJ/mol
.(2)反应2CO+O2
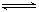 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2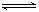 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3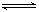 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式K=
|
K=
.
|
(3)高温下,氧化铁能跟碳发生下列反应:
①Fe2O3+3C
| ||
| ||
| n(C) |
| n(Fe2O3) |
1.5<
<3
| n(C) |
| n(Fe2O3) |
1.5<
<3
.| n(C) |
| n(Fe2O3) |
(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因
SO32-+H2O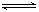 HSO3-+OH-
HSO3-+OH-
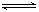 HSO3-+OH-
HSO3-+OH-SO32-+H2O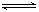 HSO3-+OH-
HSO3-+OH-
. HSO3-+OH-
HSO3-+OH-(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)
 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是①⑤
①⑤
(填序号):①增加C的量 ②多通入Cl2③升高温度 ④移走部分AlCl3(g) ⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是
与C或CO反应,提供反应所需的热量
与C或CO反应,提供反应所需的热量
.(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5mol/L时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L.此时所得沉淀中
否
否
(填“是”或“否”)含有Al(OH)3.(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33).无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业制备无水AlCl3的流程如下:
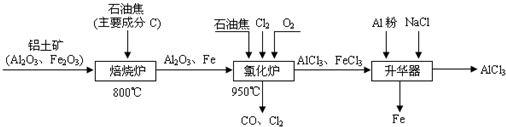
(1)已知:C(s)+
O2(g)═CO(g)△H=-110.5kJ/mol,2Fe(s)+
O2(g)═Fe2O3(s)△H=-822.1kJ/mol
请写出C还原Fe2O3生成CO的热化学方程式______.
(2)反应2CO+O2
2CO2的平衡常数为K1;反应4Fe+3O2
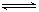
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
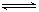
2Fe+3CO2的平衡常数K与K1、K2的关系式______.
(3)高温下,氧化铁能跟碳发生下列反应:
①Fe2O3+3C
2Fe+3CO ②Fe2O3+3CO
2Fe+3CO2若反应产生的气体是CO2和CO,则
的取值范围是______.
(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因______.
(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)
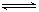
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
①增加C的量 ②多通入Cl2③升高温度 ④移走部分AlCl3(g) ⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是______.
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5mol/L时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L.此时所得沉淀中______(填“是”或“否”)含有Al(OH)3.(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33).
查看习题详情和答案>>

(1)已知:C(s)+
| 1 |
| 2 |
| 3 |
| 2 |
请写出C还原Fe2O3生成CO的热化学方程式______.
(2)反应2CO+O2
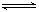
2CO2的平衡常数为K1;反应4Fe+3O2
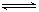
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
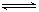
2Fe+3CO2的平衡常数K与K1、K2的关系式______.
(3)高温下,氧化铁能跟碳发生下列反应:
①Fe2O3+3C
| ||
| ||
| n(C) |
| n(Fe2O3) |
(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因______.
(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)
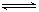
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
①增加C的量 ②多通入Cl2③升高温度 ④移走部分AlCl3(g) ⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是______.
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5mol/L时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L.此时所得沉淀中______(填“是”或“否”)含有Al(OH)3.(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33).
(2011?嘉兴模拟)M5纤维具有质量轻、强度高,防爆、防弹等多种优良性能,它的结构简式为:

下左图是有关M5纤维的转化关系图(部分反应未注明条件):


A的分子式为C8H10,其1H核磁共振谱图见右上图所示.请回答:
(1)写出A的键线式结构
 ;并写出A的有5种核磁共振谱峰的另一种异构体的结构简式
;并写出A的有5种核磁共振谱峰的另一种异构体的结构简式
 .
.
(2)写出下列化学反应方程式:
C→D
 ;
;
I→M5
 .
.
(3)等物质的量的I分别与足量NaOH和Na2CO3溶液反应,所消耗的溶质NaOH和Na2CO3的物质的量之比为
(4)若将少量J加入AlCl3溶液中,振荡后会产生白色浑浊,请解释产生白色浑浊的原因 中的-NH2可结合H2O电离出的H+,促进Al3++3H2O?Al(OH)3+3H+,向右移动,形成氢氧化铝沉淀
中的-NH2可结合H2O电离出的H+,促进Al3++3H2O?Al(OH)3+3H+,向右移动,形成氢氧化铝沉淀 中的-NH2可结合H2O电离出的H+,促进Al3++3H2O?Al(OH)3+3H+,向右移动,形成氢氧化铝沉淀.
中的-NH2可结合H2O电离出的H+,促进Al3++3H2O?Al(OH)3+3H+,向右移动,形成氢氧化铝沉淀.
(5)实验室中检验B物质中含有氯元素的简单方法是
查看习题详情和答案>>

下左图是有关M5纤维的转化关系图(部分反应未注明条件):


A的分子式为C8H10,其1H核磁共振谱图见右上图所示.请回答:
(1)写出A的键线式结构




(2)写出下列化学反应方程式:
C→D


I→M5


(3)等物质的量的I分别与足量NaOH和Na2CO3溶液反应,所消耗的溶质NaOH和Na2CO3的物质的量之比为
1:1
1:1
.(4)若将少量J加入AlCl3溶液中,振荡后会产生白色浑浊,请解释产生白色浑浊的原因
 中的-NH2可结合H2O电离出的H+,促进Al3++3H2O?Al(OH)3+3H+,向右移动,形成氢氧化铝沉淀
中的-NH2可结合H2O电离出的H+,促进Al3++3H2O?Al(OH)3+3H+,向右移动,形成氢氧化铝沉淀 中的-NH2可结合H2O电离出的H+,促进Al3++3H2O?Al(OH)3+3H+,向右移动,形成氢氧化铝沉淀
中的-NH2可结合H2O电离出的H+,促进Al3++3H2O?Al(OH)3+3H+,向右移动,形成氢氧化铝沉淀(5)实验室中检验B物质中含有氯元素的简单方法是
取B物质少量于一支试管中,加入足量NaOH溶液,用酒精灯稍加热一段时间,然后加足量的稀硝酸酸化,再滴加2~3滴AgNO3溶液,若有白色沉淀生成,说明B物质中含有氯元素
取B物质少量于一支试管中,加入足量NaOH溶液,用酒精灯稍加热一段时间,然后加足量的稀硝酸酸化,再滴加2~3滴AgNO3溶液,若有白色沉淀生成,说明B物质中含有氯元素
.