摘要:24.⑴20世纪30年代.Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理 论:化学反应并不是通过简单的碰撞就能完成.而是在反应物到生成物的过程中经过一个高能量的 过渡态.图甲是1mol白磷(P4)和足量O2反应生成P4O10过程中能量变化示意图.请写出白磷(P4) 和O2反应生成P4O10的热化学方程式: (△H用含E1和E2的代数式表示.其中E1.E2均大于0). ⑵白磷是正四面体构型的分子.当与氧气作用形成P4O6时.相当于每两个磷原子之间 插入一个氧原子.当形成P4O10时.相当于在P4O6的分子中每个磷原子又以双键结合一个 氧原子.请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑. ⑶进一步研究表明.化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简 单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据: 化学键 P-P P-O O=O P=O 键能/ kJ·mol-1 198 360 498 X 已知白磷(P4)的燃烧热为2982kJ/mol. 白磷完全燃烧的产物结构如图丁所示.则上表 中x= . ⑷写出1 mol P4与O2反应生成固态P4O6的反应热△H= .
网址:http://m.1010jiajiao.com/timu3_id_43964[举报]
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态.

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(3)下表是部分化学键的键能数据:
已知白磷的燃烧热为2982kJ/mol,白磷(P4)、P4O6、P4O10结构如下图所示,则上表中X=
(4)0.5mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为
查看习题详情和答案>>

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
C
C
(选填“A”、“B”或“C”);(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
NO2(g)+CO(g)=CO2(g)+NO(g);△H=-234kJ/mol
NO2(g)+CO(g)=CO2(g)+NO(g);△H=-234kJ/mol
;(3)下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 198 | 360 | 498 | X |
585
585
.(4)0.5mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为
819
819
kJ.20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图(本题最下方)中信息,回答下列问题:
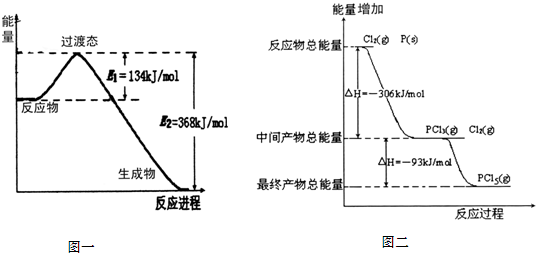
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
查看习题详情和答案>>
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234KJ/mol
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234KJ/mol
.在反应体系中加入催化剂,E1和E2的变化是:E1减小
减小
,E2减小
减小
(填“增大”、“减小”或“不变”),对反应热是否有影响?不变
不变
,原因是加入催化剂,改变反应的途径,降低反应所需的活化能
加入催化剂,改变反应的途径,降低反应所需的活化能
.(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
.PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式
PCl5(g)═PCl3(g)+Cl2(g)△H=+93KJ/mol
PCl5(g)═PCl3(g)+Cl2(g)△H=+93KJ/mol
.②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
等于
等于
△H1(填“大于”、“小于”或“等于”),原因是反应中的能量变化只与起态、终态有关,与反应的途径无关
反应中的能量变化只与起态、终态有关,与反应的途径无关
.
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中 的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
查看习题详情和答案>>
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
.在反应体系中加入催化剂,E1和E2的变化是:E1减小
减小
,E2减小
减小
(填“增大”、“减小”或“不变”),对反应热是否有影响?无影响
无影响
,原因是催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变
催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变
.(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中 的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
.②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
等于
等于
△H1(填“大于”、“小于”或“等于”),原因是根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
.
 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题:
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题:右图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。
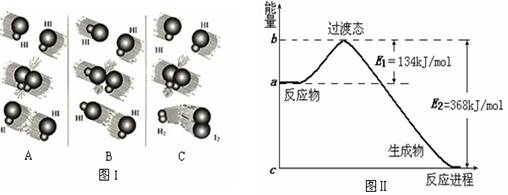
⑴图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是______(选填“A”、“B”或“C”);
⑵图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的
热化学方程式:___________________________________;
⑶下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/ kJ·mol–1 | 198 | 360 | 498 | X |
已知白磷的燃烧热为2982kJ/mol,白磷(P4)、P4O6、P4O10结构如下图所示,
则上表中X=_______________。

⑷0.5mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为___________kJ。
查看习题详情和答案>>