摘要:有一定质量的KNO3样品.在100C下加蒸馏水使之充分溶解.残留固体的质量为250g.该实验在400C下进行时.残留固体质量为120g.700C时为20g.已知KNO3在不同温度下的溶解度: 温度 100C 400C 550C 700C 溶解度 20g 65g 100g 140g 下列对该样品的推断正确的是 A.样品为纯净物 B.样品中混有不溶于水的杂质 C.样品中混有溶解度较大的杂质 D.当温度在550C左右时KNO3完全溶解 第II卷
网址:http://m.1010jiajiao.com/timu3_id_43576[举报]
有一定质量的KNO3样品,在10℃时加蒸馏水使之充分溶解,残留固体的质量为250g.该实验在40℃时进行,残留固体质量为120g,70℃时残留固体质量为20g.已知KNO3在不同温度下的溶解度:
下列对该样品的推断正确的是( )
| 温度 | 10℃ | 40℃ | 55℃ | 70℃ |
| 溶解度 | 20g | 65g | 100g | 140g |
| A、样品为纯净物 |
| B、样品中混有不溶于水的杂质 |
| C、样品中混有溶解度较大的杂质 |
| D、当温度在55℃左右时KNO3完全溶解 |
有一定质量的KNO3样品和一定质量的蒸馏水,若分别在10℃、40℃和70℃三种温度条件下进行溶解实验,充分溶解后,残留固体的质量分别为250 g、120 g和20g,已知KNO3在不同温度下的溶解度如下表:
温度 | 10℃ | 40℃ | 55℃ | 70℃ |
溶解度 | 20g | 65g | 100g | 140g |
下列对该样品的推断中,一定不正确的是( )
A.样品为纯净物
B.样品中混有不溶于水的杂质
C.样品的总质量约为308 g
D.当温度在55℃左右,KNO3全部溶解
有一定质量的KNO3样品,在10 ℃下加蒸馏水使之充分溶解,残留固体的质量为250g。该实验在40 ℃下进行时,残留固体质量为120 g,70 ℃时为20 g。已知KNO3在不同温度下的溶解度:下列对该样品的推断正确的是:
温度 | 10 ℃ | 40 ℃ | 55 ℃ | 70 ℃ |
溶解度 | 20 g | 65 g | 100 g | 140 g |
A.样品为纯净物 B.样品中混有不溶于水的杂质
C.样品中混有溶解度较大的杂质 D.当温度在55℃ 左右时KNO3完全溶解
查看习题详情和答案>>(2013?安徽模拟)实验室可以用MgCl2?6H20为原料制备碳酸镁晶须,主要流程如下:
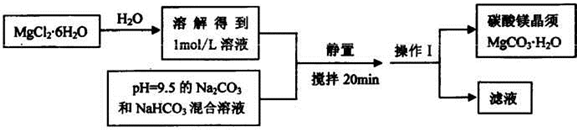
试回答:
(1)操作1的名称是
(2)上述反应过程要控制好温度,因为MgCO3置于水中长时间加热煮沸可完全生成 Mg(OH)2.其原因是
(3)另査阅文献,在加热煮沸时也可能生成碱式碳酸镁Mg(OH)2(CO3)4?4H2O,写出该反应的化学方程式
(4)某课题组为了确定MgCO3在水中长时间加热煮沸后所得的固体成分,进行如下 研究.(注:Mg(OH)2,Mg5(OH)2(CO3)4.4H2O在煮沸时均不会分解)
①定性研究:请你完成下表中内容.
②另取一定质量的固体,灼烧至恒重,能否通过固体质惫的减少量来确定固体的成分?
查看习题详情和答案>>

试回答:
(1)操作1的名称是
过滤
过滤
.(2)上述反应过程要控制好温度,因为MgCO3置于水中长时间加热煮沸可完全生成 Mg(OH)2.其原因是
MgCO3在加热煮沸过程中能发生水解反应.由于水解生成的Mg(OH)2溶解度更小,且又有CO2气体生成,使水解趋于完全,MgCO3转化为Mg(OH)2
MgCO3在加热煮沸过程中能发生水解反应.由于水解生成的Mg(OH)2溶解度更小,且又有CO2气体生成,使水解趋于完全,MgCO3转化为Mg(OH)2
.(3)另査阅文献,在加热煮沸时也可能生成碱式碳酸镁Mg(OH)2(CO3)4?4H2O,写出该反应的化学方程式
5 MgCO3+5H2O
Mg5(OH)2(CO3)4?4H2O+CO2↑
| ||
5 MgCO3+5H2O
Mg5(OH)2(CO3)4?4H2O+CO2↑
.
| ||
(4)某课题组为了确定MgCO3在水中长时间加热煮沸后所得的固体成分,进行如下 研究.(注:Mg(OH)2,Mg5(OH)2(CO3)4.4H2O在煮沸时均不会分解)
①定性研究:请你完成下表中内容.
| 实验步骤 | 预期的实验现象和结论 |
| 取一定质量的固体样品 置于试管中,滴加足量的稀盐酸 (或置于试管中充分加热,将产生的气体通入到盛有足量澄清石灰水的烧杯) 置于试管中,滴加足量的稀盐酸 (或置于试管中充分加热,将产生的气体通入到盛有足量澄清石灰水的烧杯) |
若 无气泡生成 (或澄清石灰水不变浑浊 ) 无气泡生成 ,则固体产物为Mg(OH)2(或澄清石灰水不变浑浊 ) |
能
能
(填“能”或“否”),理由是等质量的氢氧化镁或碱式碳酸镁灼烧至恒重时,固体质量的减少量是确定的,且不相同
等质量的氢氧化镁或碱式碳酸镁灼烧至恒重时,固体质量的减少量是确定的,且不相同
.(2012?泰州二模)谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡:
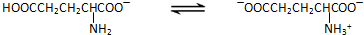
(1)当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.实验室中检验淀粉水解产物可选用的试剂是
A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
(2)“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量.其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R-NH2+HCHO→R-N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定.
①上述测定过程中加入甲醛的目的是
②滴定终点的实验现象为
(3)味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量.
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,
②乙方案:取mg味精溶于水,加入过量浓度为c1mol?L-1的AgNO3溶液,再加入少量
%
%.
查看习题详情和答案>>
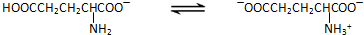
(1)当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.实验室中检验淀粉水解产物可选用的试剂是
AC
AC
.A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
(2)“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量.其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R-NH2+HCHO→R-N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定.
①上述测定过程中加入甲醛的目的是
掩蔽氨基,避免氨基影响羧基和NaOH的中和反应
掩蔽氨基,避免氨基影响羧基和NaOH的中和反应
.②滴定终点的实验现象为
溶液由无色变为红色且半分钟不褪色
溶液由无色变为红色且半分钟不褪色
.(3)味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量.
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,
过滤、洗涤、干燥
过滤、洗涤、干燥
(填写操作步骤),称量沉淀质量.②乙方案:取mg味精溶于水,加入过量浓度为c1mol?L-1的AgNO3溶液,再加入少量
Fe(NO3)3
Fe(NO3)3
溶液做指示剂,用浓度为c2mol?L-1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点.已知:AgSCN是难溶于水的沉淀.设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是| 5.85(c1V1-c2V2) |
| m |
| 5.85(c1V1-c2V2) |
| m |