题目内容
有一定质量的KNO3样品和一定质量的蒸馏水,若分别在10℃、40℃和70℃三种温度条件下进行溶解实验,充分溶解后,残留固体的质量分别为250 g、120 g和20g,已知KNO3在不同温度下的溶解度如下表:温度 | 10℃ | 40℃ | 55℃ | 70℃ |
溶解度 | 20g | 65g | 100g | 140g |
下列对该样品的推断中,一定不正确的是( )
A.样品为纯净物
B.样品中混有不溶于水的杂质
C.样品的总质量约为308 g
D.当温度在55℃左右,KNO3全部溶解
A
【解析】 本题考查溶解度的计算。设原来有溶剂x g,40℃以后升高温度,固体继续溶解,说明40 ℃及其以下温度时是饱和的,10℃到40 ℃,溶解度增加45 g,现多溶解了130 g,说明原来有溶剂130/45×100 g=289 g,可以算出从40℃到70 ℃,还可以溶解75×289/100 g=217 g,而40℃时,剩余固体120 g,所以70℃时,未饱和,那么20 g就是不溶物。原有溶质(以40℃时算),已溶289/100×65 g=188 g,未溶120g-20 g=100 g,共288 g,则原样品288 g+20 g=308 g。完全溶解是溶解度为288/289×100 g,约为100 g,即55℃。

| 温度 | 10℃ | 40℃ | 55℃ | 70℃ |
| 溶解度 | 20g | 65g | 100g | 140g |
| A、样品为纯净物 |
| B、样品中混有不溶于水的杂质 |
| C、样品中混有溶解度较大的杂质 |
| D、当温度在55℃左右时KNO3完全溶解 |
高氯酸钾广泛用于火箭及热电池业。实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到。
(1)写出实验室制取高氯酸钾的化学方程式:___ _。
(2)用蒸馏水多次洗涤晶体的目的是______________ __。
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体, I、使固体全部溶解。II、在100oC时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体![]() 。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品
。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品![]() 。IV、重结晶得KNO3纯品
。IV、重结晶得KNO3纯品![]() 。
。
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10oC | 80.5 | 20.9 | 35.7 | 31.0 |
| 100oC | 175 | 246 | 39.1 | 56.6 |
①操作III中采用减压过滤,装置如右图所示,仪器A和B的名称分别是
,
②该装置有三处错误,分别是
,
③若实验过程中发现倒吸现象,应采取的措施是 。
(4) KNO3晶体纯品的产率 。 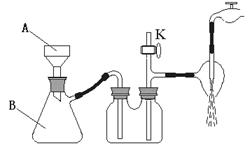
有一定质量的KNO3样品,在10 ℃下加蒸馏水使之充分溶解,残留固体的质量为250g。该实验在40 ℃下进行时,残留固体质量为120 g,70 ℃时为20 g。已知KNO3在不同温度下的溶解度:下列对该样品的推断正确的是:
温度 | 10 ℃ | 40 ℃ | 55 ℃ | 70 ℃ |
溶解度 | 20 g | 65 g | 100 g | 140 g |
A.样品为纯净物 B.样品中混有不溶于水的杂质
C.样品中混有溶解度较大的杂质 D.当温度在55℃ 左右时KNO3完全溶解
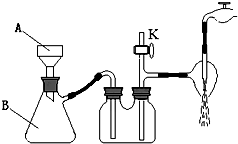 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.