摘要: 83.常温下往100mLFeCl3溶液中通人0.224LH2S.结果生成单质S.再加人过量铁粉.反应停止后溶液中含有0.06mol阳离子.原FeCl3溶液的浓度是 mol/L.
网址:http://m.1010jiajiao.com/timu3_id_435145[举报]
下列有关电解质溶液的说法不正确的是( )
| A、pH均为2的盐酸和醋酸溶液分别稀释100倍后,pH都变为4 | B、常温下,pH=7的醋酸钠和醋酸混合溶液中c(Na+)=c(CH3COO-) | C、常温下,测得0.1mol/L HF溶液的pH=2,据此可推断出它是弱电解质 | D、往混有Fe3+的CuCl2溶液中加入CuO以调节溶液pH,可除去其中Fe3+ |
常温下,往过氧化氢中滴加少量FeSO4溶液,可发生如下两个反应:
①2Fe2++H2O2+2H+═2Fe3++2H2O
②2Fe3++H2O2═2Fe2++O2↑+2H+
下列关于反应历程的说法中不合理的是( )
①2Fe2++H2O2+2H+═2Fe3++2H2O
②2Fe3++H2O2═2Fe2++O2↑+2H+
下列关于反应历程的说法中不合理的是( )
| A、H2O2氧化性比Fe3+强,其还原性比Fe2+强 | B、在反应前和反应完成后,溶液pH保持不变 | C、H2O2的生成过程要严格避免混入Fe3+或Fe2+ | D、反应中,Fe3+和Fe2+总物质的量始终在改变 |
下列有关物质的应用,说法不正确的是( )
| A、常温下,浓硫酸或浓硝酸可以用铝槽车运输 | B、检验食盐是否加碘(KIO3),直接往所配待测液滴加淀粉液,观察溶液是否变蓝 | C、氧化镁和氧化铝熔点很高,可以用于制造耐高温材料 | D、高压钠灯充有钠蒸汽,常用于广场照明 |
(2011?烟台模拟)铬抗腐蚀性高,在钢中含量达到12%称为不锈钢.工业上冶炼铬的主要步骤如图所示:
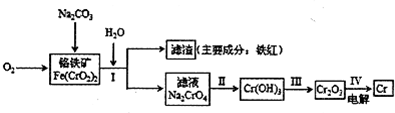
试回答下列问题
(1)已如步骤Ⅱ的反应方程式为:
8Na2CrO4+6Na2S+23H2O→8Cr(OH)3↓十3Na2S2O3十22NaOH
该反应中氧化剂是
(2)步骤IV中电解Cr2O3的阳极反应式为
(3)常温下,铬能慢慢溶于稀盐酸、稀硫酸,但不溶于浓硝酸.其不溶于浓硝酸的原因可能是
(4)已如:2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
①25.C,KSP(Ag2Cr2O4)=1.12×10-12,KSP(Ag2Cr2O7)=2×10-7,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是
②将wg固体Na2CrO4溶于适量水配成lL溶液,该溶液中有关粒子的浓度(mol?L-1)与pH的关系如下表:

由上表可知:
Ⅰ.要使溶液中CrO42-的量达到最大,应控制溶液的pH
Ⅱ. w g固体Na2CrO4的物质的量n=
查看习题详情和答案>>

试回答下列问题
(1)已如步骤Ⅱ的反应方程式为:
8Na2CrO4+6Na2S+23H2O→8Cr(OH)3↓十3Na2S2O3十22NaOH
该反应中氧化剂是
Na2CrO4
Na2CrO4
(填化学式),生成 lmolCr(OH)3时转移电子的物质的量为3
3
mol.(2)步骤IV中电解Cr2O3的阳极反应式为
2O2--4e-═O2↑
2O2--4e-═O2↑
,此时Cr2O3?的状态为液态(或熔融态)
液态(或熔融态)
.(3)常温下,铬能慢慢溶于稀盐酸、稀硫酸,但不溶于浓硝酸.其不溶于浓硝酸的原因可能是
表面生成致密氧化膜(或发生钝化)
表面生成致密氧化膜(或发生钝化)
.(4)已如:2CrO42-+2H+
 Cr2O72-+H2O
Cr2O72-+H2O①25.C,KSP(Ag2Cr2O4)=1.12×10-12,KSP(Ag2Cr2O7)=2×10-7,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是
Ag2CrO4
Ag2CrO4
.②将wg固体Na2CrO4溶于适量水配成lL溶液,该溶液中有关粒子的浓度(mol?L-1)与pH的关系如下表:

由上表可知:
Ⅰ.要使溶液中CrO42-的量达到最大,应控制溶液的pH
>9
>9
(用>、<、=及相关数据表示).Ⅱ. w g固体Na2CrO4的物质的量n=
n(CrO42-)+c(Cr2O72-)+n(HCrO4-)
n(CrO42-)+c(Cr2O72-)+n(HCrO4-)
(用数学表达式表示).