题目内容
常温下,往过氧化氢中滴加少量FeSO4溶液,可发生如下两个反应:
①2Fe2++H2O2+2H+═2Fe3++2H2O
②2Fe3++H2O2═2Fe2++O2↑+2H+
下列关于反应历程的说法中不合理的是( )
①2Fe2++H2O2+2H+═2Fe3++2H2O
②2Fe3++H2O2═2Fe2++O2↑+2H+
下列关于反应历程的说法中不合理的是( )
| A、H2O2氧化性比Fe3+强,其还原性比Fe2+强 | B、在反应前和反应完成后,溶液pH保持不变 | C、H2O2的生成过程要严格避免混入Fe3+或Fe2+ | D、反应中,Fe3+和Fe2+总物质的量始终在改变 |
分析:两个反应的总方程式为2H2O2═2H2O+O2↑,反应中Fe2+为催化剂,氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,结合反应的相关方程式解答该题.
解答:解:A.由反应①可知,H2O2氧化性比Fe3+强,由反应②可知,H2O2还原性比Fe2+强,故A正确;
B.在反应前和反应完成后,溶液呈中性(如考虑H2O2的电离和Fe2+的水解,则略呈酸性),pH基本不变,故B正确;
C.往过氧化氢中滴加少量FeSO4溶液,发生反应生成氧气,过氧化氢变质,则应严格避免混入Fe3+或Fe2+,故C正确;
D.两个反应的总方程式为2H2O2═2H2O+O2↑,反应中Fe2+为催化剂,总物质的不变,而Fe3+是中间产物,故D错误.
故选:D.
B.在反应前和反应完成后,溶液呈中性(如考虑H2O2的电离和Fe2+的水解,则略呈酸性),pH基本不变,故B正确;
C.往过氧化氢中滴加少量FeSO4溶液,发生反应生成氧气,过氧化氢变质,则应严格避免混入Fe3+或Fe2+,故C正确;
D.两个反应的总方程式为2H2O2═2H2O+O2↑,反应中Fe2+为催化剂,总物质的不变,而Fe3+是中间产物,故D错误.
故选:D.
点评:本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力和自学能力的考查,注意把握题给信息,为解答该题的关键,难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
|
常温下,往过氧化氢中滴加少量FeSO4溶液,可发生如下两个反应: ①2Fe2++H2O2+2H+ ②2Fe3++H2O2 下列关于反应历程的说法不合理的是 | |
| [ ] | |
A. |
H2O2氧化性比Fe3+强,其还原性比Fe2+强 |
B. |
在反应前和反应完全后,溶液pH保持不变 |
C. |
H2O2的生产过程要严格避免混入Fe2+ |
D. |
反应过程中,Fe2+和Fe3+,总物质的量始终在改变 |
常温下,往过氧化氢溶液中滴加少量FeSO4溶液,可发生如下两个反应:
①2Fe2++H2O2+2H+===2Fe3++2H2O;②2Fe3++H2O2===2Fe2++O2↑+2H+。下列关于反应历程的说法不合理的是
| A.H2O2氧化性比Fe3+强,其还原性比Fe2+强 |
| B.在反应前和反应完全后,溶液pH保持不变 |
| C.H2O2的生产过程要严格避免混入Fe2+ |
| D.反应过程中,Fe2+和Fe3+总物质的量始终在改变 |
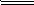 2Fe3++2H2O;
2Fe3++2H2O;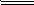 2Fe2++O2+2H+
2Fe2++O2+2H+