摘要:8.如图.如果说图中实心小球是N2.空心小球是O2.那么这些 气体混合物可以反应生成多少分子NO2 (A) 4分子 (B) 5分子 (C) 6分子 (D) 8分子
网址:http://m.1010jiajiao.com/timu3_id_434916[举报]
某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最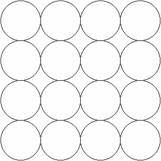 密堆积形式Ax 。如右图所示为Ax 堆积的片层形式,然后第二层就堆积在第一层的空隙上。请根据Ax 的堆积形式回答:
密堆积形式Ax 。如右图所示为Ax 堆积的片层形式,然后第二层就堆积在第一层的空隙上。请根据Ax 的堆积形式回答:
(1)计算在片层结构中(如右图所示)球数、空隙数和切点数之比
(2)在Ax 堆积中将会形成正八面体空隙和正四面体空隙。请在片层图中画出正八面体空隙(用?表示)和正四面体空隙(用×表示)的投影,并确定球数、正八面体空隙数和正四面体空隙数之比
(3)指出Ax 堆积中小球的配位数
(4)计算Ax 堆积的原子空间利用率。
(5)计算正八面体和正四面体空隙半径(可填充小球的最大半径,设等径小球的半径为r)。
(6)已知金属Ni晶体结构为Ax 堆积形式,Ni原子半径为124.6 pm,计算金属Ni的密度。(Ni的相对原子质量为58.70)
(7)如果CuH 晶体中Cu+的堆积形式为Ax 型,H- 填充在空隙中,且配位数是4。则H- 填充的是哪一类空隙,占有率是多少?
(8)当该同学将这种Ax 堆积形式告诉老师时,老师说Ax 就是A1或A3的某一种。你认为是哪一种,为什么?
查看习题详情和答案>> 过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)
D
D
,H2O2既体现氧化性又体现还原性的反应是C
C
,H2O2体现酸性的反应是A
A
.(2)上述反应说明H2O2、Ag2O、K2CrO4氧化性顺序是
Ag2O>H2O2>K2CrO4
Ag2O>H2O2>K2CrO4
.(3)保存过氧化氢试剂瓶上的最适合贴上的一个标签是
B
B
(填序号);
(4)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO-4、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.
①反应体系选择的酸是:
C
C
(填序号).A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为
0.6
0.6
mol.(5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实验:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为
KHCO3
KHCO3
,并阐明H2O2被称为绿色氧化剂的理由是H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性
H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性
.(6)图是实验室制取氢气的常用装置,但却不能用于过氧化氢在二氧化锰催化作用下分解制氧气.某同学经过认真研究,
借助生活中的某种建筑材料和二氧化锰创造性地解决了上述问题.你认为他的做法是
将二氧化锰粉末与水泥按一定比例制成块状固体
将二氧化锰粉末与水泥按一定比例制成块状固体
.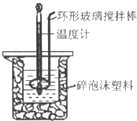 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指
(4)计算该实验发生中和反应时放出的热量为
(5)如果用50mL 0.55mol?L一的氨水(NH3?H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是
某同学将一定浓度的Na2CO3溶液加入CuSO4溶液中,发现生成了沉淀.其对沉淀的成分进行如下探究:
【提出假设】
假设1:沉淀是CuCO3;
假设2: ;
假设3:沉淀是CuCO3和Cu(OH)2的混合物.
【验证假设】
(1)如果假设1成立,则反应的离子方程式为 .
(2)用离子方程式表示假设3中有Cu(OH)2生成的理论依据: .
(3)为证明以上哪种假设成立,该同学用如图装置测定沉淀样品中CuCO3的质量分数:
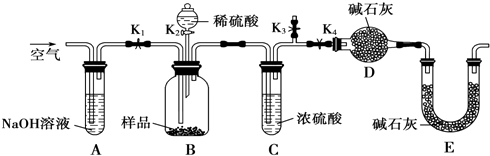
①实验时的步骤依次为:
a.打开K1、K3,关闭K2、K4,通入过量空气;
b.关闭K1、K3,打开K2、K4,充分反应;
c.打开K1、K4,关闭K2、K3,通入过量空气,
若未进行步骤a,将使测定结果 .实验结束时通入过量空气的目的是 .
②若沉淀样品的质量为10.0g,装置D的质量增加了2.2g,则沉淀中CuCO3的质量分数为 .
③由以上实验可知,假设 成立.
【总结反思】除了以上方案,还可以设计其它方案通过测量 来测定沉淀中CuCO3的质量分数.
查看习题详情和答案>>
【提出假设】
假设1:沉淀是CuCO3;
假设2:
假设3:沉淀是CuCO3和Cu(OH)2的混合物.
【验证假设】
(1)如果假设1成立,则反应的离子方程式为
(2)用离子方程式表示假设3中有Cu(OH)2生成的理论依据:
(3)为证明以上哪种假设成立,该同学用如图装置测定沉淀样品中CuCO3的质量分数:

①实验时的步骤依次为:
a.打开K1、K3,关闭K2、K4,通入过量空气;
b.关闭K1、K3,打开K2、K4,充分反应;
c.打开K1、K4,关闭K2、K3,通入过量空气,
若未进行步骤a,将使测定结果
②若沉淀样品的质量为10.0g,装置D的质量增加了2.2g,则沉淀中CuCO3的质量分数为
③由以上实验可知,假设
【总结反思】除了以上方案,还可以设计其它方案通过测量
 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:(1)①该反应的化学方程式是
2X 3Y+Z
3Y+Z
 3Y+Z
3Y+Z2X 3Y+Z
3Y+Z
. 3Y+Z
3Y+Z②在t1min时,该反应达到了
平衡
平衡
状态,下列可作为判断反应已达到该状态的是D
D
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为2:3
C.生成3mol Y的同时生成1mol Z
D.生成1mol Z的同时生成2mol X
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1min时,该反应吸收的热量为:
36.8kJ
36.8kJ
;在此t1min时间内,用H2表示反应的平均速率v(H2)=| 0.6 |
| t1 |
| 0.6 |
| t1 |
②两位同学讨论放热反应和吸热反应.甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应.你认为他们说法正确的是
乙
乙
同学.