题目内容
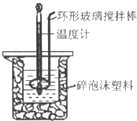 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指
(4)计算该实验发生中和反应时放出的热量为
(5)如果用50mL 0.55mol?L一的氨水(NH3?H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是
分析:(1)量取50mL盐酸或者氢氧化钠溶液使用玻璃仪器为量筒和胶头滴管;
(2)中和热测定实验成败的关键是减少热量的损失;
(3)中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
(4)先判断数据的有效性,然后计算出平均温度差,再根据Q=m?c?△T计算反应放出的热量;
(5)根据NH3?H2O是弱电解质,弱电解质电离吸热进行分析.
(2)中和热测定实验成败的关键是减少热量的损失;
(3)中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
(4)先判断数据的有效性,然后计算出平均温度差,再根据Q=m?c?△T计算反应放出的热量;
(5)根据NH3?H2O是弱电解质,弱电解质电离吸热进行分析.
解答:解:(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是量筒和胶头滴管,
故答案为:量简和胶头滴管;
(2)中和热测定实验中,必须尽量减少实验过程中热量的损失,
故答案为:减少实验过程中的热量损失;
(3)氢氧化钠溶液与盐酸完全反应后混合溶液的最高温度为终止温度,
故答案为:完全反应后混合溶液的最高;
(4)第三次得到温度差误差较大,应该舍弃,所以平均温度差为:
=3.2℃,溶液的质量为:100ml×1g/ml=100g,则该反应中放出的热量为:Q=m?c?△T=100g×4.18J/(g?℃)×3.2℃=1340J,即1.34kJ,
故答案为:1.34 kJ;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,
故答案为:NH3?H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等).
故答案为:量简和胶头滴管;
(2)中和热测定实验中,必须尽量减少实验过程中热量的损失,
故答案为:减少实验过程中的热量损失;
(3)氢氧化钠溶液与盐酸完全反应后混合溶液的最高温度为终止温度,
故答案为:完全反应后混合溶液的最高;
(4)第三次得到温度差误差较大,应该舍弃,所以平均温度差为:
| 3.25℃+3.15℃ |
| 2 |
故答案为:1.34 kJ;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,
故答案为:NH3?H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等).
点评:本题考查学生有关中和热的测定知识,题目难度不大,注意掌握中和热的测定方法,明确中和热与酸、碱的物质的量无关,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目

