摘要:27].某课外兴趣小组为了探究碱性溶液中Mg2+.Al3+与溶液pH的关系.进行下列实验:向含有0.1mol HCl.0.1mol MgCl2.1.0mol AlCl3的混合溶液中逐渐加入NaOH溶液.均至反应后溶液体积1L.测得部分实验数据如下表: pH 9 10 11 c(Mg2+)/mol·L-1 10-1 10-3 10-5 c(AlO2―)/mol·L-1 10-2 10-1 1 (1)向混合溶液中加入NaOH溶液至pH=9.能否有Mg(OH)2沉淀出现 .由此你得到的初步结论是 . (2)向混合溶液中加入NaOH溶液至pH=10.需要NaOH溶液中有多少克NaOH?
网址:http://m.1010jiajiao.com/timu3_id_434883[举报]
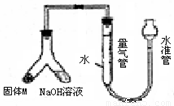
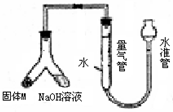 某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验.(1)如何检验该装置的气密性
安装好装置并在量气管内加人水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装量密封
安装好装置并在量气管内加人水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装量密封
.(2)合金样品固体M与氢氧化钠溶液反应的离子方程式
2OH-+2Al+6H2O═2[Al(OH)4]-+3H2↑
2OH-+2Al+6H2O═2[Al(OH)4]-+3H2↑
.(3)倾斜左边装置使氢氧化钠溶液(足量)与ag合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为VmL(已折算成标准状况).若量气管最大量程为50mL.,则固体M中铝的质量(mA1)范围为
0<mAl<0.04g
0<mAl<0.04g
.(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积
>
>
(填“>”“<”“=”)VmL.(5)若a=38mg,V=44.8mL(标准状况),请通过计算说明该合金是否符合国家标准(不写计算过程)
符合
符合
(填“符合”或“不符合”). 某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:
某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:(1)通过试管乙中发生的
褪色
褪色
现象说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有
漂白
漂白
性.(2)写出试管甲所发生的化学反应方程式
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(3)试管乙口放置有碱液的棉花的作用是
吸收有毒的尾气,防止污染大气
吸收有毒的尾气,防止污染大气
.(4)实验中,取一定质量的铜片和浓硫酸放在试管甲中共热,直到反应完毕,最后发现试管甲中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①下列药品中能用来证明反应结束后的试管甲中确有余酸的是
AD
AD
.A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
②为测定上述反应中铜消耗的质量,还需进行的实验是:取出试管甲内反应后的混合液,
向其中加入足量的
NaOH
NaOH
试剂,然后进行的操作步骤是bed
bed
.(选出测定过程中所需的基本操作且按操作先后顺序列出).(a)萃取、分液 (b)过滤、洗涤
(c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧.
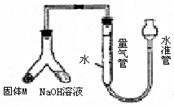
 某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.(1)如何检验该装置的气密性
安装好装置并在量气管内加水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装量密封(合理即给分)
安装好装置并在量气管内加水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装量密封(合理即给分)
.(2)样品与氢氧化钠溶液反应的离子方程式:
2OH-+2Al+6H2O=2[AI(OH)4]-+3H2↑(或2OH-+2Al+2H2O=2AlO2-+3H2↑)
2OH-+2Al+6H2O=2[AI(OH)4]-+3H2↑(或2OH-+2Al+2H2O=2AlO2-+3H2↑)
.(3)使足量氢氧化钠溶液与ag合金(固体M)充分反应,进入量气管的气体体积为VmL(已换算成标准状况,下同).若a=0.036,V=22.4,该合金中铝的质量分数是
50%或0.5
50%或0.5
.(4)若将装置中的氢氧化钠替换为足量的盐酸,与ag合金粉末充分反应,则进入量气管内的气体体积
>
>
(填“>”“<”“=”)VmL;利用此方法测得的气体体积能否进行铝的含量计算?能
能
(填“能”或“否”)