题目内容
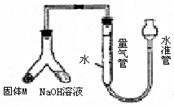
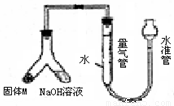
 某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:
某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:(1)通过试管乙中发生的
褪色
褪色
现象说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有
漂白
漂白
性.(2)写出试管甲所发生的化学反应方程式
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(3)试管乙口放置有碱液的棉花的作用是
吸收有毒的尾气,防止污染大气
吸收有毒的尾气,防止污染大气
.(4)实验中,取一定质量的铜片和浓硫酸放在试管甲中共热,直到反应完毕,最后发现试管甲中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①下列药品中能用来证明反应结束后的试管甲中确有余酸的是
AD
AD
.A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
②为测定上述反应中铜消耗的质量,还需进行的实验是:取出试管甲内反应后的混合液,
向其中加入足量的
NaOH
NaOH
试剂,然后进行的操作步骤是bed
bed
.(选出测定过程中所需的基本操作且按操作先后顺序列出).(a)萃取、分液 (b)过滤、洗涤
(c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧.
分析:(1)品红褪色,说明二氧化硫有漂白性,说明铜和浓硫酸发生化学反应生成二氧化硫;
(2)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水;
(3)依据二氧化硫是污染性气体,不能排放到大气中分析;
(4)①检验有H+存在;
②使生成的Cu2+转化为沉淀,通过过滤、洗涤、烘干或灼烧、冷却、称量,测定其质量.
(2)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水;
(3)依据二氧化硫是污染性气体,不能排放到大气中分析;
(4)①检验有H+存在;
②使生成的Cu2+转化为沉淀,通过过滤、洗涤、烘干或灼烧、冷却、称量,测定其质量.
解答:解:(1)品红褪色,说明二氧化硫有漂白性,说明铜和浓硫酸发生化学反应生成二氧化硫,故答案为:褪色;漂白;
(2)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水,其反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(3)反应后的尾气中含有二氧化硫,二氧化硫有毒,直接排放都空气中会污染空气,氢氧化钠溶液的作用是:吸收反应产生的SO2,防止污染空气,
故答案为:吸收有毒的尾气,防止污染大气;
(4)①能用来证明反应结束后的烧瓶中确有余酸,实质证明氢离子的存在,
A.铁粉与稀硫酸反应放气体,可以证明;
B.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,故不能证明;
C.银粉不与稀硫酸反应不能证明;
D.Na2CO3溶液会与稀硫酸反应发出二氧化碳气体,可以证明,
故答案为:AD;
②加入氢氧化钠使生成的Cu2+转化为沉淀,通过过滤、洗涤、烘干或灼烧、冷却、称量,测定其质量;
故答案为:NaOH;bed.
(2)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水,其反应方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(3)反应后的尾气中含有二氧化硫,二氧化硫有毒,直接排放都空气中会污染空气,氢氧化钠溶液的作用是:吸收反应产生的SO2,防止污染空气,
故答案为:吸收有毒的尾气,防止污染大气;
(4)①能用来证明反应结束后的烧瓶中确有余酸,实质证明氢离子的存在,
A.铁粉与稀硫酸反应放气体,可以证明;
B.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,故不能证明;
C.银粉不与稀硫酸反应不能证明;
D.Na2CO3溶液会与稀硫酸反应发出二氧化碳气体,可以证明,
故答案为:AD;
②加入氢氧化钠使生成的Cu2+转化为沉淀,通过过滤、洗涤、烘干或灼烧、冷却、称量,测定其质量;
故答案为:NaOH;bed.
点评:本题考查了浓硫酸的性质应用,反应产物的验证、测定方法的设定和判断,关键是产物中的二氧化硫性质的应用.

练习册系列答案
相关题目
 某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验. 某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.