摘要:6.晶种制备的原料为硫酸或氢氟酸.水玻璃.水.分别使用HF和H2SO4合成晶种.生成的冰晶石检验结果如下: 制备晶种用酸对冰晶石质量的影响 酸 F/% Al% Na/% Na︰Al SiO2 Fe2O3 SO42- HF 53.00 13.26 31.00 2.74 0.564 0.010 0.11 H2SO4 52.58 12.68 31.82 2.95 0.247 0.006 1.49 从实验结果看.使用 制晶种.合成的冰晶石质量较好.简述你的理由.
网址:http://m.1010jiajiao.com/timu3_id_434636[举报]
 (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时,2p 轨道处于半充满状态 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
| Z | Z 的一种核素的质量数为65,中子数为 36 |
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为
5:1
5:1
,其中心原子采取sp2
sp2
杂化;(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含
共价
共价
键,属于原子
原子
晶体;(3)Y 的基态原子的核外电子排布式为
[Ar]3d54s1
[Ar]3d54s1
;(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有 18 个电子.乙和丙的化学式分别是
C2H6
C2H6
、H2O2
H2O2
,两者沸点的关系为乙<
<
丙(填“>”或“<”),原因是H2O2分子见存在氢键,C2H6分子间不存在氢键
H2O2分子见存在氢键,C2H6分子间不存在氢键
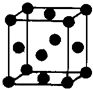
;(5)Z单质晶体的晶胞如右图所示,其配位数为:
12
12
.金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
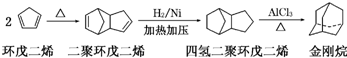
请回答下列问题:
(1)1mol环戊二烯与等物质的量的溴反应的方程式为 +Br2→
+Br2→ 或
或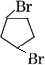
 +Br2→
+Br2→ 或
或 .
.
环戊二烯分子中最多有
(2)金刚烷的分子式为
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
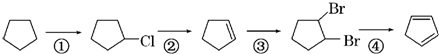
其中,反应①的化学方程式为 +Cl2
+Cl2

 +Cl2
+Cl2
 ,
,
反应②的反应试剂和反应条件是
反应④的化学方程式为 +2NaOH
+2NaOH
 +2NaBr
+2NaBr +2NaOH
+2NaOH
 +2NaBr.
+2NaBr.
查看习题详情和答案>>

请回答下列问题:
(1)1mol环戊二烯与等物质的量的溴反应的方程式为
 +Br2→
+Br2→ 或
或
 +Br2→
+Br2→ 或
或
环戊二烯分子中最多有
10
10
个原子共平面.(2)金刚烷的分子式为
C10H16
C10H16
,其分子中的CH2基团有6
6
个.(3)下面是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应①的化学方程式为
 +Cl2
+Cl2| 光照 |

 +Cl2
+Cl2| 光照 |

反应②的反应试剂和反应条件是
NaOH/醇溶液
NaOH/醇溶液
,反应③的反应类型是加成反应
加成反应
.反应④的化学方程式为
 +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr
+2NaBr +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr
+2NaBr氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域中有重要用途.
Ⅰ.工业上有多种方法来制备氮化硅,常见的方法:
方法一 直接氮化法:在1 300~1 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为 .
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是 .
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si3N4和一种气体 (填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为 .
Ⅱ.(1)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有 .
(2)已知:25℃,101kPa条件下的热化学方程式:
3Si(s)+2N2(g)═Si3N4(s)△H=-750.2kJ/mol ①
Si(s)+2C12(g)═SiCl4(g)△H=-609.6kJ/mol ②
H2(g)+
C12(g)═HCl(g)△H=-92.3kJ/mol ③
请写出四氯化硅气体与氮气、氢气反应的热化学方程式: .
Ⅲ.工业上制取高纯硅和四氯化硅的生产流程如下:
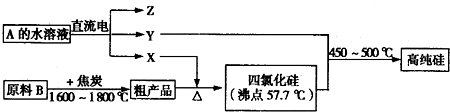
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是 (填化学式).
(2)写出焦炭与原料B中的主要成分反应的化学方程式: .
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu? (填“能”或“不能”).写出Cu为阳极电解A的水溶液开始一段时间阴、阳极的电极反应方程式.阳极: ;阴极: .
查看习题详情和答案>>
Ⅰ.工业上有多种方法来制备氮化硅,常见的方法:
方法一 直接氮化法:在1 300~1 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si3N4和一种气体
Ⅱ.(1)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有
(2)已知:25℃,101kPa条件下的热化学方程式:
3Si(s)+2N2(g)═Si3N4(s)△H=-750.2kJ/mol ①
Si(s)+2C12(g)═SiCl4(g)△H=-609.6kJ/mol ②
| 1 |
| 2 |
| 1 |
| 2 |
请写出四氯化硅气体与氮气、氢气反应的热化学方程式:
Ⅲ.工业上制取高纯硅和四氯化硅的生产流程如下:

已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是
(2)写出焦炭与原料B中的主要成分反应的化学方程式:
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu?
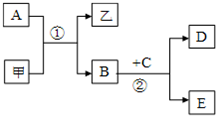 图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.(1)若A、B为金属单质;在常温下C为无色液体;甲常作红色油漆的颜料;乙溶于烧碱溶液.则甲是
铁红
铁红
(填俗称);乙溶于烧碱溶液的离子方程式为Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
;反应②的化学方程式为3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
(2)若A、B为同主族非金属单质;E的水溶液呈碱性,向其中加入过量稀盐酸,生成白色胶状沉淀.则甲可用作制取
光导纤维、晶体硅或玻璃等
光导纤维、晶体硅或玻璃等
(填两种)的原料;向E溶液中通入过量二氧化碳,反应的离子方程式为SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
;A与浓硫酸反应的化学方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2?6H2O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表
实验室欲制备硫酸亚铁铵晶体,设计了如下方案.
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去
②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为
③加入
(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a
②加热、浓缩溶液时,不浓缩至干的理由是
③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是
④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在
Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
Ⅲ) 判断该反应到达滴定终点的现象为
Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为
mol/L.
查看习题详情和答案>>
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去
铁屑表面的油污
铁屑表面的油污
,倒掉溶液,用蒸馏水把铁冲洗干净,干燥,备用;②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为
硫酸亚铁
硫酸亚铁
(填名称,不考虑水解),其物质的量约为0.045
0.045
mol;③加入
5.94
5.94
g硫酸铵到蒸发皿中,缓缓加热、浓缩至表面出现结晶膜为止、冷却,得硫酸亚铁铵晶体.(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a
过滤洗涤操作速度要快
过滤洗涤操作速度要快
;b步骤③要缓缓加热,避免沸腾
步骤③要缓缓加热,避免沸腾
;②加热、浓缩溶液时,不浓缩至干的理由是
因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解
因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解
;③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是
因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小
因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小
;④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在
酸式
酸式
(酸式或碱式)滴定管,操作时用右
右
手拿锥形瓶;Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
;Ⅲ) 判断该反应到达滴定终点的现象为
当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点
当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点
;Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为
| 1 |
| V |
| 1 |
| V |