题目内容
 (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时,2p 轨道处于半充满状态 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
| Z | Z 的一种核素的质量数为65,中子数为 36 |
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为
5:1
5:1
,其中心原子采取sp2
sp2
杂化;(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含
共价
共价
键,属于原子
原子
晶体;(3)Y 的基态原子的核外电子排布式为
[Ar]3d54s1
[Ar]3d54s1
;(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有 18 个电子.乙和丙的化学式分别是
C2H6
C2H6
、H2O2
H2O2
,两者沸点的关系为乙<
<
丙(填“>”或“<”),原因是H2O2分子见存在氢键,C2H6分子间不存在氢键
H2O2分子见存在氢键,C2H6分子间不存在氢键
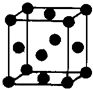
;(5)Z单质晶体的晶胞如右图所示,其配位数为:
12
12
.分析:U所处的周期数、族序数分别与其原子序数相等,故U为氢;
V基态时,电子分布在三个能级上,且各能级中电子数相等,则核外电子排布为1s22s22p2,则V为碳元素;
W基态时,2p 轨道处于半充满状态,核外电子排布为1s22s22p3,则W为氮元素;
X与W元素处于同一周期,且X的第一电离能小于W的第一电离,故X为氧元素;
Y是第四周期元素中未成对电子数最多的元素,故Y为铬元素;
Z 的一种核素的质量数为65,中子数为36,则质子数为65-36=29,为铜元素;
(1)乙烯的产量作为衡量石油化工发展水平的标志;
(2)C和N形成C3N4,其硬度比金刚石大,故为原子晶体;
(3)铬为24号元素,根据构造原理书写核外电子排布式;
(4)C和H形成的18电子化合物为C2H4,O和H形成的18电子化合物为H2O2;
(5)每个晶胞中与一个顶点上铜原子距离最近的铜原子数是3,每个顶点上铜原子被8个晶胞占有,据此计算铜原子配位数.
V基态时,电子分布在三个能级上,且各能级中电子数相等,则核外电子排布为1s22s22p2,则V为碳元素;
W基态时,2p 轨道处于半充满状态,核外电子排布为1s22s22p3,则W为氮元素;
X与W元素处于同一周期,且X的第一电离能小于W的第一电离,故X为氧元素;
Y是第四周期元素中未成对电子数最多的元素,故Y为铬元素;
Z 的一种核素的质量数为65,中子数为36,则质子数为65-36=29,为铜元素;
(1)乙烯的产量作为衡量石油化工发展水平的标志;
(2)C和N形成C3N4,其硬度比金刚石大,故为原子晶体;
(3)铬为24号元素,根据构造原理书写核外电子排布式;
(4)C和H形成的18电子化合物为C2H4,O和H形成的18电子化合物为H2O2;
(5)每个晶胞中与一个顶点上铜原子距离最近的铜原子数是3,每个顶点上铜原子被8个晶胞占有,据此计算铜原子配位数.
解答:解:U所处的周期数、族序数分别与其原子序数相等,故U为氢;
V基态时,电子分布在三个能级上,且各能级中电子数相等,则核外电子排布为1s22s22p2,则V为碳元素;
W基态时,2p 轨道处于半充满状态,核外电子排布为1s22s22p3,则W为氮元素;
X与W元素处于同一周期,且X的第一电离能小于W的第一电离,故X为氧元素;
Y是第四周期元素中未成对电子数最多的元素,故Y为铬元素;
Z 的一种核素的质量数为65,中子数为36,则质子数为65-36=29,为铜元素;
(1)H和C形成的化合物,常把它的产量作为衡量石油化工发展水平的标志,故该化合物为乙烯,乙烯中σ键和π键的个数比为5:1,碳原子采取sp2杂化,
故答案为:5:1;sp2;
(2)C和N形成C3N4,其硬度比金刚石大,故为原子晶体,C-N为共价键,故答案为:共价;原子;
(3)铬为24号元素,基态原子的核外电子排布式为[Ar]3d54s1,故答案为:[Ar]3d54s1;
(4)C和H形成的18电子化合物为C2H4,O和H形成的18电子化合物为H2O2,两者都为分子晶体,由于双氧水中含有氢键,故沸点:H2O2>C2H4,
故答案为:C2H4;H2O2;<;
(5)在铜的晶胞中,顶点上的铜原子被8个晶胞占有,每个晶胞中与一个顶点上铜原子距离最近的铜原子数是3,每个面上的铜原子被2个晶胞占有,所以其配位数是3×8÷2=12,故答案为:12.
V基态时,电子分布在三个能级上,且各能级中电子数相等,则核外电子排布为1s22s22p2,则V为碳元素;
W基态时,2p 轨道处于半充满状态,核外电子排布为1s22s22p3,则W为氮元素;
X与W元素处于同一周期,且X的第一电离能小于W的第一电离,故X为氧元素;
Y是第四周期元素中未成对电子数最多的元素,故Y为铬元素;
Z 的一种核素的质量数为65,中子数为36,则质子数为65-36=29,为铜元素;
(1)H和C形成的化合物,常把它的产量作为衡量石油化工发展水平的标志,故该化合物为乙烯,乙烯中σ键和π键的个数比为5:1,碳原子采取sp2杂化,
故答案为:5:1;sp2;
(2)C和N形成C3N4,其硬度比金刚石大,故为原子晶体,C-N为共价键,故答案为:共价;原子;
(3)铬为24号元素,基态原子的核外电子排布式为[Ar]3d54s1,故答案为:[Ar]3d54s1;
(4)C和H形成的18电子化合物为C2H4,O和H形成的18电子化合物为H2O2,两者都为分子晶体,由于双氧水中含有氢键,故沸点:H2O2>C2H4,
故答案为:C2H4;H2O2;<;
(5)在铜的晶胞中,顶点上的铜原子被8个晶胞占有,每个晶胞中与一个顶点上铜原子距离最近的铜原子数是3,每个面上的铜原子被2个晶胞占有,所以其配位数是3×8÷2=12,故答案为:12.
点评:本题考查元素周期律、原子晶体、核外电子排布、氢键以及配位数的计算,综合性较强,难度中等.

练习册系列答案
相关题目


