题目内容
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域中有重要用途.
Ⅰ.工业上有多种方法来制备氮化硅,常见的方法:
方法一 直接氮化法:在1 300~1 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为 .
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是 .
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si3N4和一种气体 (填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为 .
Ⅱ.(1)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有 .
(2)已知:25℃,101kPa条件下的热化学方程式:
3Si(s)+2N2(g)═Si3N4(s)△H=-750.2kJ/mol ①
Si(s)+2C12(g)═SiCl4(g)△H=-609.6kJ/mol ②
H2(g)+
C12(g)═HCl(g)△H=-92.3kJ/mol ③
请写出四氯化硅气体与氮气、氢气反应的热化学方程式: .
Ⅲ.工业上制取高纯硅和四氯化硅的生产流程如下:
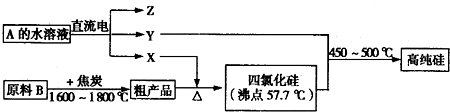
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是 (填化学式).
(2)写出焦炭与原料B中的主要成分反应的化学方程式: .
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu? (填“能”或“不能”).写出Cu为阳极电解A的水溶液开始一段时间阴、阳极的电极反应方程式.阳极: ;阴极: .
Ⅰ.工业上有多种方法来制备氮化硅,常见的方法:
方法一 直接氮化法:在1 300~1 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si3N4和一种气体
Ⅱ.(1)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有
(2)已知:25℃,101kPa条件下的热化学方程式:
3Si(s)+2N2(g)═Si3N4(s)△H=-750.2kJ/mol ①
Si(s)+2C12(g)═SiCl4(g)△H=-609.6kJ/mol ②
| 1 |
| 2 |
| 1 |
| 2 |
请写出四氯化硅气体与氮气、氢气反应的热化学方程式:
Ⅲ.工业上制取高纯硅和四氯化硅的生产流程如下:

已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是
(2)写出焦炭与原料B中的主要成分反应的化学方程式:
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu?
分析:Ⅰ、方法一、硅与氮气反应生成氮化硅;
方法二、方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体;
方法三、根据原子守恒判断四氯化硅与氨气反应生成的气体;
根据原子守恒判断Si(NH2)4分解生成的气体;
Ⅱ、(1)氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,该铵盐是NH4F;
(2)根据盖斯定律书写目标热化学方程式;
Ⅲ、原料B与碳得到粗产品与X反应,生成SiCl4,则X为氯气,原料B与碳得到粗产品为Si,故B为SiO2.Y与氯气在光照或点燃条件下可反应,且与SiCl4反应得到高纯度Si,则Y为氢气.Z的焰色呈黄色,含有Na元素,电解A得到氢气、氯气与Z,则Z为NaOH、A为NaCl,据此解答.
方法二、方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体;
方法三、根据原子守恒判断四氯化硅与氨气反应生成的气体;
根据原子守恒判断Si(NH2)4分解生成的气体;
Ⅱ、(1)氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,该铵盐是NH4F;
(2)根据盖斯定律书写目标热化学方程式;
Ⅲ、原料B与碳得到粗产品与X反应,生成SiCl4,则X为氯气,原料B与碳得到粗产品为Si,故B为SiO2.Y与氯气在光照或点燃条件下可反应,且与SiCl4反应得到高纯度Si,则Y为氢气.Z的焰色呈黄色,含有Na元素,电解A得到氢气、氯气与Z,则Z为NaOH、A为NaCl,据此解答.
解答:解:Ⅰ、方法一、硅与氮气反应生成氮化硅,反应方程式为:3Si+2N2
Si3N4,
故答案为:3Si+2N2
Si3N4;
方法二、方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体,故方法二得到氮化硅纯度较高,
故答案为:方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体;
方法三、四氯化硅与氨气反应生成Si(NH2)4与一种气体,反应中四氯化硅与氨气按1:4反应,故生成气体中Cl原子与H原子数目之比为4:(4×3-2×4)=1:1,故生成气体为HCl;
Si(NH2)4分解生成Si3N4与一种气体,则Si(NH2)4与Si3N4按3:1进行,故生成气体中含有N、H原子,二者数目之比为(4×3-4):2×4×3=8:24=1:3,故该气体为NH3,
故答案为:HCl;NH3;
Ⅱ、(1)氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,该铵盐是NH4F,含有离子键、共价键,
故答案为:离子键、共价键;
(2)已知:3Si(s)+2N2(g)═Si3N4(s)△H=-750.2kJ/mol ①
Si(s)+2C12(g)═SiCl4(g)△H=-609.6kJ/mol ②
H2(g)+
C12(g)═HCl(g)△H=-92.3kJ/mol ③
根据盖斯定律,①-②×3+③×12得:3SiCl4(g)+2N2(g)+6H2(g)=Si3N4(g)+12HCl(g);△=-29.0kJ/mol,
故答案为:3SiCl4(g)+2N2(g)+6H2(g)=Si3N4(g)+12HCl(g);△=-29.0kJ/mol;
Ⅲ、原料B与碳得到粗产品与X反应,生成SiCl4,则X为氯气,原料B与碳得到粗产品为Si,故B为SiO2.Y与氯气在光照或点燃条件下可反应,且与SiCl4反应得到高纯度Si,则Y为氢气.Z的焰色呈黄色,含有Na元素,电解A得到氢气、氯气与Z,则Z为NaOH、A为NaCl,
(1)由上述分析可知,原料B的主要成分是SiO2,
故答案为:SiO2;
(2)焦炭与SiO2反应生成Si与CO,反应方程式为:SiO2+2C
Si+2CO↑,
故答案为:SiO2+2C
Si+2CO↑;
(3)上述生产流程中电解NaCl的水溶液时,阳极氯离子放电生成氯气,阳极材料若为Cu,则Cu放电,氯离子不能放电生成氯气,故阳极材料不能为Cu;
Cu为阳极电解NaCl的水溶液开始一段时间,阳极Cu放电生成铜离子,阳极电极反应式为:Cu-2e-=Cu2+,
阴极水放电生成氢气与氢氧根离子,阴极电极反应式为:2H2O+2e-=H2↑+2OH-,
故答案为:不能;Cu-2e-=Cu2+;2H2O+2e-=H2↑+2OH-.
| ||
故答案为:3Si+2N2
| ||
方法二、方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体,故方法二得到氮化硅纯度较高,
故答案为:方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体;
方法三、四氯化硅与氨气反应生成Si(NH2)4与一种气体,反应中四氯化硅与氨气按1:4反应,故生成气体中Cl原子与H原子数目之比为4:(4×3-2×4)=1:1,故生成气体为HCl;
Si(NH2)4分解生成Si3N4与一种气体,则Si(NH2)4与Si3N4按3:1进行,故生成气体中含有N、H原子,二者数目之比为(4×3-4):2×4×3=8:24=1:3,故该气体为NH3,
故答案为:HCl;NH3;
Ⅱ、(1)氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,该铵盐是NH4F,含有离子键、共价键,
故答案为:离子键、共价键;
(2)已知:3Si(s)+2N2(g)═Si3N4(s)△H=-750.2kJ/mol ①
Si(s)+2C12(g)═SiCl4(g)△H=-609.6kJ/mol ②
| 1 |
| 2 |
| 1 |
| 2 |
根据盖斯定律,①-②×3+③×12得:3SiCl4(g)+2N2(g)+6H2(g)=Si3N4(g)+12HCl(g);△=-29.0kJ/mol,
故答案为:3SiCl4(g)+2N2(g)+6H2(g)=Si3N4(g)+12HCl(g);△=-29.0kJ/mol;
Ⅲ、原料B与碳得到粗产品与X反应,生成SiCl4,则X为氯气,原料B与碳得到粗产品为Si,故B为SiO2.Y与氯气在光照或点燃条件下可反应,且与SiCl4反应得到高纯度Si,则Y为氢气.Z的焰色呈黄色,含有Na元素,电解A得到氢气、氯气与Z,则Z为NaOH、A为NaCl,
(1)由上述分析可知,原料B的主要成分是SiO2,
故答案为:SiO2;
(2)焦炭与SiO2反应生成Si与CO,反应方程式为:SiO2+2C
| ||
故答案为:SiO2+2C
| ||
(3)上述生产流程中电解NaCl的水溶液时,阳极氯离子放电生成氯气,阳极材料若为Cu,则Cu放电,氯离子不能放电生成氯气,故阳极材料不能为Cu;
Cu为阳极电解NaCl的水溶液开始一段时间,阳极Cu放电生成铜离子,阳极电极反应式为:Cu-2e-=Cu2+,
阴极水放电生成氢气与氢氧根离子,阴极电极反应式为:2H2O+2e-=H2↑+2OH-,
故答案为:不能;Cu-2e-=Cu2+;2H2O+2e-=H2↑+2OH-.
点评:本题考查对信息的提取利用、常用化学用语、无机物推断、电解原理等,难度中等,(3)中推断物质是解题的关键,有助于学生能力的考查,必须活学活用才能解好这类试题.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
氮化硅(Si3N4)是一种具有耐高温、耐磨蚀等优异性能的新型陶瓷.工业上可用如下反应来制取:3SiO2+6C+2N2
Si3N4+6CO下列说法中不正确的是( )
| ||
| A、氮化硅陶瓷可用于制造汽车发动机 |
| B、氮化硅中氮元素的化合价为─3 |
| C、氮化硅陶瓷属于新型无机非金属材料 |
| D、氮化硅不会与任何酸发生反应 |
氮化硅(Si3N4)是一种新型陶瓷材料,800℃下,石英、焦炭和氮气通过以下反应可制得氮化硅.3SiO2(s)+6C(s)+2N2(g)
Si3N4(s)+6CO(g)
(1)该反应中的氧化产物是 .
(2)800℃下,该反应的平衡常数表达式K= .
(3)已知:该反应K800℃>K 850℃,则该反应是 反应.(填“放热”或“吸热”).
(4)一定温度下,在2L密闭容器内,充入一定量SiO2、C、N2进行上述反应,N2的物质的量随时间(t)的变化如下表:
从反应初到平衡时,CO的平均生成速率为v(CO)= mol/(L?min).
(5)若压缩(4)中的密闭体系,则上述平衡向 反应方向移动.(填“正”或“逆”).
(6)能使SiO2的转化率增大的措施是 .(填标号)
A.及时分离出CO气体 B.降低温度 C.增加C的初始量 D.使用适宜催化剂.
| ||
(1)该反应中的氧化产物是
(2)800℃下,该反应的平衡常数表达式K=
(3)已知:该反应K800℃>K 850℃,则该反应是
(4)一定温度下,在2L密闭容器内,充入一定量SiO2、C、N2进行上述反应,N2的物质的量随时间(t)的变化如下表:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(N2)/mol | 2.00 | 1.40 | 1.12 | 1.00 | 1.00 | 1.00 |
(5)若压缩(4)中的密闭体系,则上述平衡向
(6)能使SiO2的转化率增大的措施是
A.及时分离出CO气体 B.降低温度 C.增加C的初始量 D.使用适宜催化剂.
