网址:http://m.1010jiajiao.com/timu3_id_434630[举报]
(1)ClO2的分子构型为_______________。
(2)制备反应方程式为__________________________________________。
(3)用此法制备获得的ClO2和其他生成物分离的方法是________________。
查看习题详情和答案>>|
由于工业化的加快和社会环保理念的淡薄,在工业发达的长三角和珠三角地区,水质的恶化已引起相当严重的后果,用蒸馏的方法可以获得纯净的饮用水.实验室用此法制备纯净水的实验中,需要的仪器是 | |
| [ ] | |
A. |
分液漏斗 |
B. |
蒸馏烧瓶 |
C. |
冷凝管 |
D. |
试管 |
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是
(2)用该方法获得的Na2S2O3.H2O晶体中常混有一定量的杂质.某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水).
[提出假设]
假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:
[查阅资料]
①SO2+2H2S═3S↓+2H2O
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
Na2S2O3+H2SO4═Na2SO4+S↑+SO2↑+H2O
③CuSO4+H2S=CuS↓(黑色)+H2SO4
[判断与思考]
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理?
[设计方案进行实验]
基于假设1,完成下表实验方案、现象及结论(仪器自选).
限选实验试剂:3mol?L-1H2SO4、1mol?L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
用0.010mol?L-1的碘水进行多次取样滴定,测得Na2S2O3?5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是

回答下列问题:
(1)在上述流程中,“过滤”用到的玻璃仪器:普通漏斗、玻璃棒、
(2)实验室可用浓盐酸和固体KMnO4直接反应制备Cl2.此反应的离子方程式为

请从图2中挑选所需的仪器,完成图1装置简图(可添加必要的塞子、玻璃导管、胶皮管.不画固定装置),并标明容器中所装试剂名称.

(3)按上述流程操作,需称取Fe粉的质量应不少于
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:
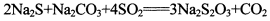 o
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
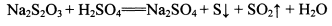
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: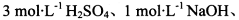 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水

(3) 已知: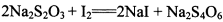 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用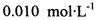 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得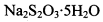 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
查看习题详情和答案>>
