题目内容
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:
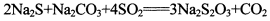 o
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
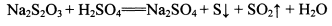
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: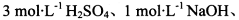 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水

(3) 已知: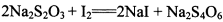 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用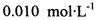 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得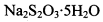 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
(1)赶走水中的溶解氧(或空气) (2分)
(2)晶体中含Na2S和Na2CO3两种杂质(2分)
不合理;(1分) Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出。(2分)
|
实验方案 |
现象及结论 |
|
取适量晶体于烧瓶中,加入足量3 mol∙L-1 H2SO4,塞上带导气管的橡皮塞,将产生的气体导出并依次通过盛有酸性KMnO4溶液、品红溶液、澄清石灰水的洗气瓶。(2分) |
品红溶液不褪色、澄清石灰水变浑浊,晶体中含Na2CO3杂质(2分) |
(其他合理答案均给分)
(3)晶体中含有杂质(如Na2S等)在滴定时参与反应或晶体部分失去结晶水(2分)(其他合理答案均给分)
【解析】晶体的主体Na2S2O3·5H2O与稀H2SO4反应生成的SO2对H2S和CO2的检验都有干扰,在检验时应充分考虑;考虑到晶体中含有的杂质(Na2S)在滴定时参与反应,是解答第(3)小题的关键。


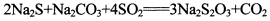 o
o
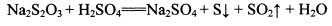
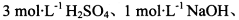 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用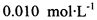 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得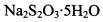 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。