题目内容
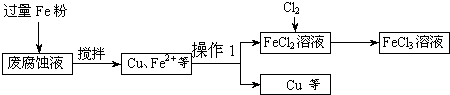
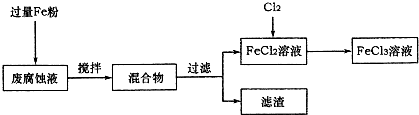
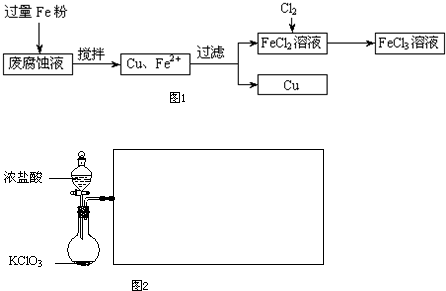
印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.测得某废腐蚀液中含CuCl2 1.5mol?L-1、FeCl2 3.0mol?L-1、FeCl3 1.0mol?L-1、HCl 3.0mol?L-1.取废腐蚀液200mL按如下流程在实验室进行实验:

回答下列问题:
(1)在上述流程中,“过滤”用到的玻璃仪器:普通漏斗、玻璃棒、
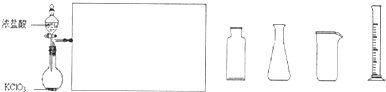
(2)实验室可用浓盐酸和固体KMnO4直接反应制备Cl2.此反应的离子方程式为

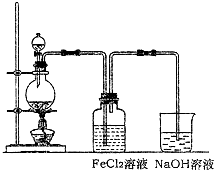
请从图2中挑选所需的仪器,完成图1装置简图(可添加必要的塞子、玻璃导管、胶皮管.不画固定装置),并标明容器中所装试剂名称.

(3)按上述流程操作,需称取Fe粉的质量应不少于

回答下列问题:
(1)在上述流程中,“过滤”用到的玻璃仪器:普通漏斗、玻璃棒、
烧杯
烧杯
;用上述方法获得的铜粉中含有杂质,除杂所需试剂是HCl
HCl
(填化学式).(2)实验室可用浓盐酸和固体KMnO4直接反应制备Cl2.此反应的离子方程式为
2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
.此反应中体现了盐酸的酸性和还原性
酸性和还原性
性质.利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液.
请从图2中挑选所需的仪器,完成图1装置简图(可添加必要的塞子、玻璃导管、胶皮管.不画固定装置),并标明容器中所装试剂名称.

(3)按上述流程操作,需称取Fe粉的质量应不少于
39.2
39.2
g,需通入Cl2的物质的量不少于0.75
0.75
mol.分析:(1)根据过滤操作;根据铜粉中浑有铁粉;
(2)根据实验室制氯气写出方程式;浓盐酸在反应中生成盐时表现酸性,生成氯气时表现还原性;根据Cl2与FeCl2反应生成FeCl3,考虑尾气吸收;
(3)根据铁与CuCl2、FeCl3、HCl反应求出参加反应的铁粉的质量;根据Cl2与FeCl2反应生成FeCl3计算出Cl2的物质的量;
(2)根据实验室制氯气写出方程式;浓盐酸在反应中生成盐时表现酸性,生成氯气时表现还原性;根据Cl2与FeCl2反应生成FeCl3,考虑尾气吸收;
(3)根据铁与CuCl2、FeCl3、HCl反应求出参加反应的铁粉的质量;根据Cl2与FeCl2反应生成FeCl3计算出Cl2的物质的量;
解答:解:(1)过滤操作需要的仪器有:烧杯、玻璃棒、漏斗;因铜粉中混有铁粉,所以用盐酸除去铁粉,故答案为:烧杯;
HCl;
(2)实验室制氯气可用:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,改为离子反应时Cl2和H2O应保留化学式,
其余物质均写成离子形式,则离子反应为2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O;由反应可知,盐酸参与反应生成KCl和MnCl2时表现其酸性,生成Cl2时表现其还原性;Cl2与FeCl2反应生成FeCl3,尾气要吸收;
故答案为:2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O;酸性和还原性;
(3)Fe+CuCl2 =FeCl2 +Cu
0.3mol 1.5mol?L-1×0.2L 0.3mol
Fe+2FeCl3 =3FeCl2
0.1mol 1.0mol?L-1×0.2L 0.3mol
Fe+2HCl=FeCl2 +H2↑
0.3mol 3.0mol?L-1×0.2L 0.3mol
共消耗Fe粉的物质的量为0.7mol,生成FeCl2的物质的量为 0.9mol,原溶液中含有FeCl2=3.0mol?L-1×0.2L=0.6mol
Fe粉的质量为0.7mol×56g/mol=39.2g,
Cl2+2FeCl2 =2FeCl3
0.75mol 1.5mol
故答案为:39.2;0.75;
HCl;
(2)实验室制氯气可用:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,改为离子反应时Cl2和H2O应保留化学式,
其余物质均写成离子形式,则离子反应为2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O;由反应可知,盐酸参与反应生成KCl和MnCl2时表现其酸性,生成Cl2时表现其还原性;Cl2与FeCl2反应生成FeCl3,尾气要吸收;
故答案为:2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O;酸性和还原性;

(3)Fe+CuCl2 =FeCl2 +Cu
0.3mol 1.5mol?L-1×0.2L 0.3mol
Fe+2FeCl3 =3FeCl2
0.1mol 1.0mol?L-1×0.2L 0.3mol
Fe+2HCl=FeCl2 +H2↑
0.3mol 3.0mol?L-1×0.2L 0.3mol
共消耗Fe粉的物质的量为0.7mol,生成FeCl2的物质的量为 0.9mol,原溶液中含有FeCl2=3.0mol?L-1×0.2L=0.6mol
Fe粉的质量为0.7mol×56g/mol=39.2g,
Cl2+2FeCl2 =2FeCl3
0.75mol 1.5mol
故答案为:39.2;0.75;
点评:本题主要考查了学生铁及化合物的性质,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目