网址:http://m.1010jiajiao.com/timu3_id_434191[举报]
![]() 由小分子组装而成的具有一定高级结构的巨分子有时也称为“超分子”,图中的十二面体是1999年合成的迄今最大的非生物高分子,化学式C2000H2300N60P120S60O200F180Pt60,相对分子质量达61955,直径达7.5nm,相当于小蛋白质分子的尺寸,右边是其原子堆积模型,该种分子由 种元素组成,每个分子中共有 个原子。
由小分子组装而成的具有一定高级结构的巨分子有时也称为“超分子”,图中的十二面体是1999年合成的迄今最大的非生物高分子,化学式C2000H2300N60P120S60O200F180Pt60,相对分子质量达61955,直径达7.5nm,相当于小蛋白质分子的尺寸,右边是其原子堆积模型,该种分子由 种元素组成,每个分子中共有 个原子。
![]() 康力龙属国际奥委会宣布禁用的合成类固醇,此药物对肝功能有明显损害作用,过量使用还会产生女子男性化,男子过早秃顶,肝中毒,甚至肝癌等毒副作用。已知康力龙的相对分子质量为328,在康力龙分子中,C占76.83%,H占9.76%,N占8.54%,O占4.88%。设康力龙的化学式为CWHXNYOZ,已知X=32,Y=2,Z=1,则W= 。
康力龙属国际奥委会宣布禁用的合成类固醇,此药物对肝功能有明显损害作用,过量使用还会产生女子男性化,男子过早秃顶,肝中毒,甚至肝癌等毒副作用。已知康力龙的相对分子质量为328,在康力龙分子中,C占76.83%,H占9.76%,N占8.54%,O占4.88%。设康力龙的化学式为CWHXNYOZ,已知X=32,Y=2,Z=1,则W= 。
![]() 用作医用麻醉剂的“笑气”是一种氮的氧化物,其中氮元素的化合价为+1价,“笑气”的化学式是 。
用作医用麻醉剂的“笑气”是一种氮的氧化物,其中氮元素的化合价为+1价,“笑气”的化学式是 。
![]() 雌黄(As2S3)是一种黄色的颜料,古人写字多用黄纸,写错后就用雌黄涂抹后重写,故有今天的“信口雌黄”一说,喻做“不顾事实,随便乱说”。雌黄中只含有硫(S)和砷(As)两种元素,请画出硫原子的结构示意图 ,在雌黄中As的化合价是 。
雌黄(As2S3)是一种黄色的颜料,古人写字多用黄纸,写错后就用雌黄涂抹后重写,故有今天的“信口雌黄”一说,喻做“不顾事实,随便乱说”。雌黄中只含有硫(S)和砷(As)两种元素,请画出硫原子的结构示意图 ,在雌黄中As的化合价是 。
![]() 海洛因、鸦片和大麻都是严重危害人类健康的毒品,其中大麻主要成分的化学式为C21H30O2,在空气中焚烧大麻,其主要成分的化学方程式是: 。
海洛因、鸦片和大麻都是严重危害人类健康的毒品,其中大麻主要成分的化学式为C21H30O2,在空气中焚烧大麻,其主要成分的化学方程式是: 。

[提出问题]1.金属钠能否置换出硫酸铜溶液中的铜?2.金属钠能否在其他气体(如:CO2)中燃烧?
[查阅资料]金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠.金属钠还可以与水剧烈反应放出氢气.
[实验探究]实验一:①在实验室中,金属钠保存在煤油中;②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红.
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质.
[问题讨论](1)金属钠保存在煤油中的原因
(2)根据上述资料写出钠块投入水中所发生的反应方程式:
| ||
| ||
(3)实验二中生成的黑色颗粒是
①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是Na2O,乙认为是Na2CO3,丙认为是Na2O和Na2CO3的混合物,丁认为是NaOH.
我认为认为丁的猜想是错误的,理由是
②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有Na2O.
方案2:取该样品少量于试管里,滴加足量稀盐酸,溶液中有气泡冒出,结论:白色物质中一定有
方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的
③评价与反思:大家认为实验方案1得出的结论不正确,其理由是
实验室中的金属钠着火时,你的灭火方法是
[拓展应用]小明同学为测定实验过程中所用的标示质量分数为32%的盐酸 (图1)的实际质量分数,他与小组的其他同学用pH测定仪组成实验装置(图2).实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加人该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液pH的关系图(图3).

①发生反应的化学方程式为:
②请以此次测定的结果,可计算出该盐酸的实际质量分数是
③请分析你的计算结果与标签标示的质量分数不一致的可能原因:

(1)甲同学设计了如图1所示装置.向内置试管中滴入足量浓氨水,一段时间后,观察到酚酞溶液变为红色,此现象说明分子具有的性质是
(2)乙同学设计了如图2所示装置.向内置试管中滴入足量稀硫酸,与碳酸钠充分反应,该反应的化学方程式为:H2SO4+Na2CO3═Na2SO4+H2O+CO2↑.
①通过仔细观察,可看到两条试纸出现的相同现象是
②将燃着的木条放在支管口处,可观察到的现象是
③综合分析①和②现象,能够总结出二氧化碳的性质有
(3)丙同学设计了如图3所示装置.向内置试管中滴入足量溶液A,一段时间后,观察到水中锌粒表面逐渐有气泡生成,则A溶液为
氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂.
[资料在线]
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝.
[探究一:定性分析]
(1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气
你支持________(填“甲”、“乙”)观点,理由是________.
(2)CaH2中氢元素的化合价是________,写出CaH2与水反应的化学方程式________;
(3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是________;
(4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.
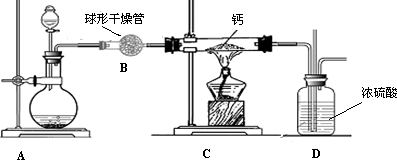
装置A中装有锌粒和稀硫酸,请写出其反应的化学方程式________,装置B中装有无水氯化钙,其作用是________,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接下图中的哪个装置:________(填①或②),现象是________.
(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确________(填“是”或“否”);原因是________.
[探究二:产物定量测定]
测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法.
(1)取氢化钙样品与水反应,利用下图装置测定生成的气体体积时,在________即进行收集(填字母).
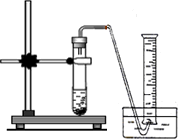
A.气泡连续均匀时
B.刚开始有气泡时
(2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用下图装置测定气体体积.该装置的优点是________,如何实现A中的水与B中样品接触而发生反应________.

(3)称取46 mg所制得的氢化钙样品,注射器D开始时活塞停留在10 mL刻度处,反应结束后充分冷却,活塞最终停留57.04 mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是________.(设该条件下每11.2 mL氢气的质量为1 mg)
[反思提高]
(1)上述实验在学校的实验室内,通过托盘天平等称量工具________(填“能”、“不能”)完成.
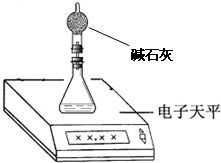
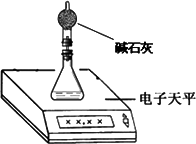
(2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏________.
【资料在线】
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝.
探究一:定性分析
(1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气你支持
(2)CaH2中氢元素的化合价是
(3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是
(4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.
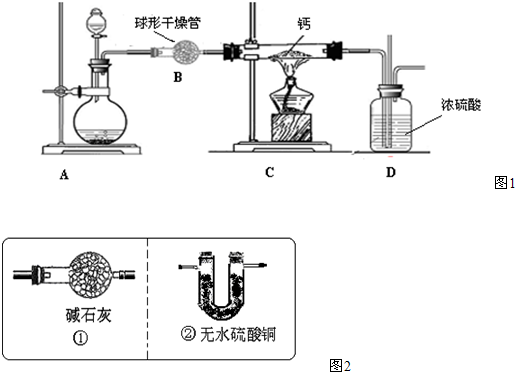
装置A 中装有锌粒和稀硫酸,请写出其反应的化学方程式
(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确
探究二:产物定量测定
测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法.
(1)取氢化钙样品与水反应,利用图1装置测定生成的气体体积时,在
A.气泡连续均匀时
B.刚开始有气泡时
(2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用图2装置测定气体体积.该装置的优点是
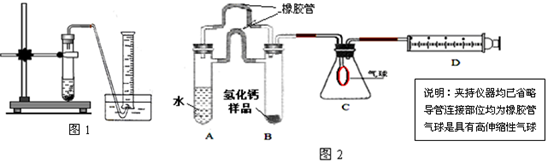
(3)称取46mg 所制得的氢化钙样品,注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是
反思提高:
(1)上述实验在学校的实验室内,通过托盘天平等称量工具
(2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏