摘要:欲降低废水中重金属元素铬的毒性.可将转化为Cr(OH)3沉淀除去. 已知: 氢氧化物开始沉淀时的pH 氢氧化物沉淀完全时的pH Fe2+ 7.0 9.0 Fe3+ 1.9 3.2 Cr3+ 6.0 8.0 (1)某含铬废水处理的主要流程如图-22所示: ①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O.用离子方程式表示其反应原理是 . ②反应池中发生主要反应的离子方程式是++5H+=2Cr3+++4H2O.根据“沉淀法 和“中和法 的原理.向沉淀池中加入NaOH溶液.此过程中发生主要反应的离子方程式是 . .证明Cr3+沉淀完全的方法是 . (2)工业可用电解法来处理含废水.实验室利用如图-23模拟处理含的废水.阳极反应式是Fe-2e-=Fe2+.阴极反应式是2 H+ +2e-=H2↑.Fe2+与酸性溶液中的反应的离子方程式是 .得到的金属阳离子在阴极区可沉淀完全.从水的电离平衡角度解释其原因是 .用电解法处理该溶液中0.01mol时.至少得到沉淀的质量是 g. 答案:28.①Al3+ +3H2O= Al(OH)3+3H+ 或Al3+ +3H2O Al(OH)3+3H+ ②Cr3++ 3OH- =Cr(OH)3↓.H++ OH- = H2O.测定溶液的pH.若pH≥8.则证明Cr3+沉淀完全. (2)+6Fe2++14H+=2Cr3++6Fe3++7H2O.阴极反应消耗了水中的H+.打破了水的电离平衡.促进了水的电离.使溶液中OH-浓度增大.溶液的碱性增强.8.48
网址:http://m.1010jiajiao.com/timu3_id_434077[举报]
某课外活动小组欲降低废水中重金属元素铬的含量,查阅资料知,可将Cr2
转化为Cr(OH)3沉淀除去.
已知:
(1)将含铬废水进行如下处理:
①在废水中加入的混凝剂是一种复盐,将其配成溶液后加入过量的NaOH溶液,产生先有白色沉淀生成,后沉淀溶解的现象.用离子方程式表示该盐产生上述现象的反应原理:
②将废水中的Cr2
转化成Cr3+.配平该离子方程式:
+
③向转化后的废水中加入NaOH溶液,此过程中发生的主要反应的离子方程式是
(2)工业上可用电解法来处理含Cr2
的废水.实验室利用如图所示的装置模拟处理含Cr2
的废水.

①阳极反应式是
②Fe2+与酸性溶液中的Cr2
反应的离子方程式是
时,至少得到沉淀的质量是
查看习题详情和答案>>
| O | 2- 7 |
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物开始沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
①在废水中加入的混凝剂是一种复盐,将其配成溶液后加入过量的NaOH溶液,产生先有白色沉淀生成,后沉淀溶解的现象.用离子方程式表示该盐产生上述现象的反应原理:
Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═2H2O+AlO2-
Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═2H2O+AlO2-
.②将废水中的Cr2
| O | 2- 7 |
1
1
Cr2| O | 2- 7 |
3
3
HSO3-+5
5
H+=2
2
Cr3++3
3
SO42-+4
4
H2O
H2O
③向转化后的废水中加入NaOH溶液,此过程中发生的主要反应的离子方程式是
Cr3++3OH-═Cr(OH)3↓
Cr3++3OH-═Cr(OH)3↓
、H++OH-═H2O
H++OH-═H2O
.证明Cr3+沉淀完全的方法是测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
.(2)工业上可用电解法来处理含Cr2
| O | 2- 7 |
| O | 2- 7 |

①阳极反应式是
Fe-2e-═Fe2+
Fe-2e-═Fe2+
,阴极反应式是2H++2e-═H2↑
2H++2e-═H2↑
.②Fe2+与酸性溶液中的Cr2
| O | 2- 7 |
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.用电解法处理该溶液中的0.01molCr2| O | 2- 7 |
8.48
8.48
g.欲降低废水中重金属元素铬的毒性,可将Cr2O2-7转化为Cr(OH)3沉淀除去.
已知:
(1)某含铬废水处理的主要流程如图所示:
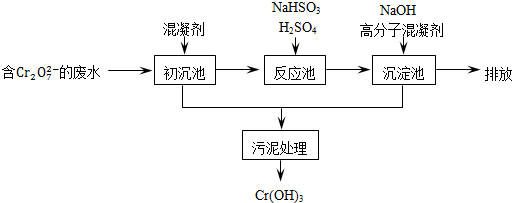
①沉池中加入的混凝剂是K2SO4?Al2(SO4)3?24H2O,用离子方程式表示其反应原理
②反应池中发生主要反应的离子方程式是Cr2O2-7+3HSO-3+5H+═2Cr3++3SO2-4+H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
(2)工业亦可用电解法来处理含Cr2O2-7废水.实验室利用如图模拟处理含Cr2O2-7的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑.Fe2+与酸性溶液中的Cr2O2-7反应生成Cr3+和Fe3+,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是:
用电解法处理该溶液中0.01molCr2O2-7时,至少得到沉淀的质量是

查看习题详情和答案>>
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | Fe2+ | 7.0 | 9.0 | Fe3+ | 1.9 | 3.2 | Cr3+ | 6.0 | 8.0 |

①沉池中加入的混凝剂是K2SO4?Al2(SO4)3?24H2O,用离子方程式表示其反应原理
Al3++3H2O?Al(OH)3(胶体)+3H+
Al3++3H2O?Al(OH)3(胶体)+3H+
.②反应池中发生主要反应的离子方程式是Cr2O2-7+3HSO-3+5H+═2Cr3++3SO2-4+H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
Cr3++3OH-═Cr(OH)3↓
Cr3++3OH-═Cr(OH)3↓
、H++OH-═H2O
H++OH-═H2O
.证明Cr3+沉淀完全的方法是测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
.(2)工业亦可用电解法来处理含Cr2O2-7废水.实验室利用如图模拟处理含Cr2O2-7的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑.Fe2+与酸性溶液中的Cr2O2-7反应生成Cr3+和Fe3+,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是:
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.用电解法处理该溶液中0.01molCr2O2-7时,至少得到沉淀的质量是
8.48
8.48
g.
欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
(1)某含铬废水处理的主要流程如图所示:
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
查看习题详情和答案>>
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |

①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
.证明Cr3+沉淀完全的方法是测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
.
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是8.48
8.48
g.(11分)欲降低废水中重金属元素铬的毒性,可将Cr2O2-7转化为Cr(OH)3沉淀除去。已知:

(1)某含铬废水处理的主要流程如图所示:

①沉池中加入的混凝剂是K2SO4·Al2(SO4)3·24H2O,用离子方程式表示其反应原理
。
②反应池中发生主要反应的离子方程式是Cr2O2—7+3HSO—3+5H+===2Cr3++3SO2—4+H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是 、 。证明Cr3+沉淀完全的方法是 。
(2)工业亦可用电解法来处理含Cr2O2-7废水。实验室利用如图模拟处理含Cr2O2-7的废水,阳极反应式是Fe—2e—===Fe2+,阴极反应式是2H++2e—=H2↑。Fe2+与酸性溶液中的Cr2O2—7反应生成Cr3+和Fe3+,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是: 。
用电解法处理该溶液中0.01molCr2O2-7时,至少得到沉淀的质量是 g。

查看习题详情和答案>>
欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
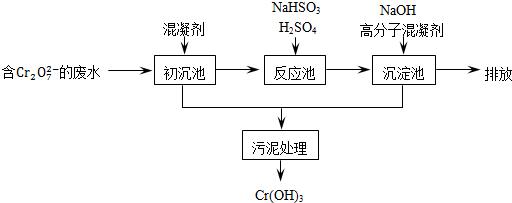
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是______.
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是______.证明Cr3+沉淀完全的方法是______.

(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是______,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是______.用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是______ g. 查看习题详情和答案>>