摘要:12.4] - (2)Zn+2NaOH+2H2O=Na2Zn(OH)4+H2 (3)①③④ (4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中.生成[Zn(NH3)4]2+.氨水的用量不易控制
网址:http://m.1010jiajiao.com/timu3_id_43406[举报]
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保护稳定的放电电压.高铁电池的总反应式为:3Zn+2K2Fe04+8H20
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| 放电 |
| 充电 |
查看习题详情和答案>>
(1)1799年,意大利物理学家伏特制成了世界上第一个电池-“伏打”电池,直接促进了人类文明的发展.下列①~⑤装置中,能构成原电池的是

(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
工业合成氨的反应是
查看习题详情和答案>>
①
①
(填序号),其正极反应式为2H++2e-=H2↑
2H++2e-=H2↑
,负极反应式为Zn-2e-=Zn 2+
Zn-2e-=Zn 2+
,电子向正极
正极
(填“正极”或“负极”,下同)运动,H+向正极
正极
运动.
(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
N2(g)+3H2(g)
2NH3(g)
| ||
| 高温高压 |
N2(g)+3H2(g)
2NH3(g)
.
| ||
| 高温高压 |
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
| 化学键 | H-H | N≡N | H-N |
| 生成(或断裂)1mol化学键时放出(或吸收)的能量 | 436kJ | 946kJ | 390kJ |
放热
放热
(填“放热”或“吸热”)反应,1molN2完全反应时对应热量的数值为92
92
kJ.废旧物的回收利用既有利于节约资源,又有利于保护环境.某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4?7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:
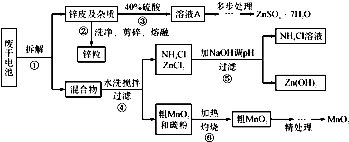
(1)操作②中所用的加热仪器应选
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:
(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
由上表数据分析应调节溶液pH最好为
a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol?L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
步骤3:向滤液中滴加0.5mol?L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为
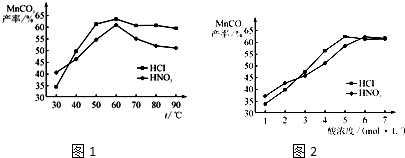
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol?L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择
查看习题详情和答案>>

(1)操作②中所用的加热仪器应选
坩埚
坩埚
(填“蒸发皿”或“坩埚”).(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
.(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
| NH3?H2O的Kb | Zn 2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
a
a
(填字母).a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol?L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
.步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
.步骤3:向滤液中滴加0.5mol?L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为
2MnCO3+O2
2MnO2+2CO2
| ||
2MnCO3+O2
2MnO2+2CO2
.
| ||
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol?L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
60
60
℃左右.②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择
6
6
mol?L-1左右.
某化学学习小组欲探究铁及其化合物的氧化性和还原性.请你协助他们完成实验报告.
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是.
(3)实验记录(在仿照①实验作答,划线部分不必填写)
(4)学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是
A、Cl2 B、Na C、Mg2+D、H2O2
(5)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,你认为是什么原因:
(6)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+,为帮助实验员进行检验少量Fe2+的存在,请从下列物质中选择合适的试剂
A、KSCN溶液 B、稀盐酸 C、KMnO4溶液 D、NaOH溶液.
查看习题详情和答案>>
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是.
(3)实验记录(在仿照①实验作答,划线部分不必填写)
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 |
铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的气体生成 |
Fe+2H+=H2↑+Fe2+ |
Fe具有还原性 |
② |
氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 |
2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 |
Fe2+具有还原性 Fe2+具有还原性 |
| ③ | 氯化亚铁溶液加 入锌片 |
锌片溶解,析出铁,溶液从浅绿色变为无色 锌片溶解,析出铁,溶液从浅绿色变为无色 |
Fe2++Zn=Fe+Zn2+ | Fe2+具有氧化性 Fe2+具有氧化性 |
④ |
在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) 在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) |
加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 |
2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ 2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ |
Fe3+具有氧化性 |
AD
AD
A、Cl2 B、Na C、Mg2+D、H2O2
(5)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,你认为是什么原因:
氯化亚铁溶液中的Fe2+被氧化
氯化亚铁溶液中的Fe2+被氧化
;你将对实验员在配制氯化亚铁溶液时,提出的建议是配制氯化亚铁溶液时要加入少量的铁粉
配制氯化亚铁溶液时要加入少量的铁粉
.(6)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+,为帮助实验员进行检验少量Fe2+的存在,请从下列物质中选择合适的试剂
C
C
A、KSCN溶液 B、稀盐酸 C、KMnO4溶液 D、NaOH溶液.
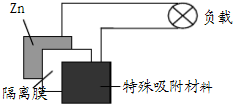 锌-空气电池因其安全、廉价而且能量密度高,科学家预测可充电锌-空气电池将引领电池革命.这种电池使用特殊材料吸附空气中的氧气,以强碱溶液为电解质.该电池放电时的总反应为2Zn+O2=2ZnO.下列判断正确的是( )
锌-空气电池因其安全、廉价而且能量密度高,科学家预测可充电锌-空气电池将引领电池革命.这种电池使用特殊材料吸附空气中的氧气,以强碱溶液为电解质.该电池放电时的总反应为2Zn+O2=2ZnO.下列判断正确的是( )| A、放电时锌作电池的正极,发生氧化反应 | B、放电时,正极反应式:Zn+2 OH--2e-=ZnO+H2O | C、充电时,阴极反应式:O2+2H2O+4e-=4 OH- | D、电池中的隔离膜只允许OH-通过 |