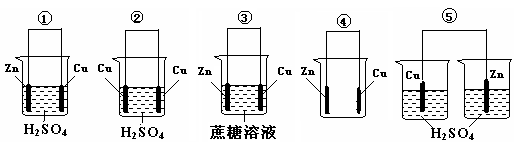
题目内容
(1)1799年,意大利物理学家伏特制成了世界上第一个电池-“伏打”电池,直接促进了人类文明的发展.下列①~⑤装置中,能构成原电池的是

(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
工业合成氨的反应是
①
①
(填序号),其正极反应式为2H++2e-=H2↑
2H++2e-=H2↑
,负极反应式为Zn-2e-=Zn 2+
Zn-2e-=Zn 2+
,电子向正极
正极
(填“正极”或“负极”,下同)运动,H+向正极
正极
运动.
(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
N2(g)+3H2(g)
2NH3(g)
| ||
| 高温高压 |
N2(g)+3H2(g)
2NH3(g)
.
| ||
| 高温高压 |
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
| 化学键 | H-H | N≡N | H-N |
| 生成(或断裂)1mol化学键时放出(或吸收)的能量 | 436kJ | 946kJ | 390kJ |
放热
放热
(填“放热”或“吸热”)反应,1molN2完全反应时对应热量的数值为92
92
kJ.分析:(1)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,根据原电池的构成条件判断;易失电子的电极作负极,另一个电极为正极,电子从负极沿导线流向正极,电解质溶液中阳离子向正极移动;
(2)①工业合成氨是利用氮气和氢气在高温、高压、催化剂条件下合成氨气;
②化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
(2)①工业合成氨是利用氮气和氢气在高温、高压、催化剂条件下合成氨气;
②化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答:解:(1)①符合原电池的构成条件,属于原电池;
②两个电极材料相同,所以不能构成原电池;
③不能自发的进行氧化还原反应,所以不能构成原电池;
④没有电解质溶液,不能自发的进行氧化还原反应,所以不能构成原电池;
⑤不能形成闭合回路,所以不能构成原电池;
铜锌原电池中,锌易失电子作负极,电极反应式为:Zn-2e-=Zn 2+,铜作正极,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,电子向正极移动,氢离子向正极移动,
故答案为:①;2H++2e-=H2↑;Zn-2e-=Zn 2+;正极;正极;
(2)①在高温、高压、催化剂条件下,氮气和氢气发生氧化还原反应生成氨气,所以合成氨反应的化学方程式为N2(g)+3H2(g)
2NH3(g),故答案为:N2(g)+3H2(g)
2NH3(g);
②在反应N2+3H2?2NH3中,1mol N2完全反应为NH3,
断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,
放出的热量为:2346kJ-2254kJ=92kJ,
故答案为:放热;92.
②两个电极材料相同,所以不能构成原电池;
③不能自发的进行氧化还原反应,所以不能构成原电池;
④没有电解质溶液,不能自发的进行氧化还原反应,所以不能构成原电池;
⑤不能形成闭合回路,所以不能构成原电池;
铜锌原电池中,锌易失电子作负极,电极反应式为:Zn-2e-=Zn 2+,铜作正极,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,电子向正极移动,氢离子向正极移动,
故答案为:①;2H++2e-=H2↑;Zn-2e-=Zn 2+;正极;正极;
(2)①在高温、高压、催化剂条件下,氮气和氢气发生氧化还原反应生成氨气,所以合成氨反应的化学方程式为N2(g)+3H2(g)
| ||
| 高温高压 |
| ||
| 高温高压 |
②在反应N2+3H2?2NH3中,1mol N2完全反应为NH3,
断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,
放出的热量为:2346kJ-2254kJ=92kJ,
故答案为:放热;92.
点评:本题考查了原电池原理及反应热,根据原电池构成条件、原电池中电子和阴阳离子的移动方向等来分析解答,注意从键能角度计算反应热,难度较大.

练习册系列答案
相关题目
 ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
 的中子数为______,该氯原子与
的中子数为______,该氯原子与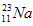 原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。