摘要:(1)防止亚铁盐被氧化, B.C , 将E中的产生的硫酸亚铁溶液压入D中 (2)缓缓加热.浓缩至表面出现结晶薄膜为止.放置冷却.过滤 (3)用氢氧化钠溶液除去混在氢气中的酸性气体,氢氧化钠溶液重复使用,用氢气驱赶氧气.防止亚铁盐被氧化,等其它合理答案
网址:http://m.1010jiajiao.com/timu3_id_43366[举报]
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4?FeSO4?6H2O]比绿矾(FeSO4?7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
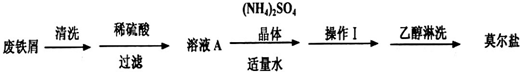
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
证明溶液A不含Fe3+离子的最佳试剂是
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、
(2)浓度均为0.1mol?L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接

将装置C中两种液体分离开的操作名称是
查看习题详情和答案>>

(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
防止Fe2+离子被氧化为Fe3+离子
防止Fe2+离子被氧化为Fe3+离子
;证明溶液A不含Fe3+离子的最佳试剂是
b
b
(填序号字母).a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、
冷却结晶
冷却结晶
、过滤.(2)浓度均为0.1mol?L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是
莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者
莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者
.(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平
左
左
(填“左”“右”)盘.(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接
d
d
;e
e
接f
f
.
将装置C中两种液体分离开的操作名称是
分液
分液
.装置D的作用是吸收多余的NH3防止污染空气,防止倒吸
吸收多余的NH3防止污染空气,防止倒吸
.工业制备氯化铜时,常将浓盐酸用蒸汽加热到80℃左右,慢慢加入粗CuO粉末(含有杂质![]() 、
、![]() )充分反映,使之溶解,得到强酸性的混合溶液,欲从该混合溶液中制备纯净的
)充分反映,使之溶解,得到强酸性的混合溶液,欲从该混合溶液中制备纯净的![]() 溶液。请参照下表给出的数据回答下列问题:
溶液。请参照下表给出的数据回答下列问题:
| 部分金属阳离子 |
|
|
|
| 以氢氧化物形式沉淀完全是的pH | ≥9.6 | ≥3.7 | ≥6.4 |
(1)第一步除去![]() ,能否直接调整pH=9.6将
,能否直接调整pH=9.6将![]() 转化为沉淀出去 (填“能”或“否”);理由是 。
转化为沉淀出去 (填“能”或“否”);理由是 。
若用强氧化剂![]() 将
将![]() 氧化为
氧化为![]() ,则加入
,则加入![]() 后,溶液的pH的变化是 。
后,溶液的pH的变化是 。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
(2)除去溶液中的![]() 的方法是调整溶液的pH=3.7,现有下列试剂均可使强酸性溶液的pH调整到3.7,可选用的有 。
的方法是调整溶液的pH=3.7,现有下列试剂均可使强酸性溶液的pH调整到3.7,可选用的有 。
A.![]() B.氨水 C.
B.氨水 C.![]() D.
D.![]() E.
E.![]() F.
F.![]()
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液,那么保存亚铁盐溶液时应该如何防止亚铁盐氧化?
查看习题详情和答案>>【化学与生活】
2010年第41届世博会在上海成功举办,其主题是“城市,让生活更美好”.
(1)低碳经济是以低能耗、低污染、低排放为基础的经济模式,上海世博会的亮点之一是实现“二氧化碳零排放”.
①世博停车场,安装有汽车尾气催化光解设施,它能将汽车尾气中CO和NOx反应生成可参与大气生态环境循环的无毒气体,写出CO和NO在一定条件下反应的化学方程式: .
②使用传统催化剂,使二氧化碳与某些有机物反应可以生成塑料,但反应时间长.目前诞生的纳米级催化剂增加了催化剂的表面积,提高了 (选填“反应速率”、“产品质量”或“原料利用率”).使用这种塑料能减少白色污染,因为它在微生物作用下,可以实现100%的降解.
③合理利用二氧化碳,可以提高生活质量,促进工业发展.在常压下,-78℃时,二氧化碳气体凝结成固态二氧化碳,俗称干冰.某学生买回一盒冰淇淋月饼,盒里有很多作为致冷剂的碎干冰.下列关于干冰处理的正确做法是
(A)将干冰放入冰箱 (B)让干冰在通风处自然升华
(C)直接将干冰倒入下水道 (D)用手取干冰扔入废物箱
④现在人们使用乙醇汽油作为汽车燃料充分体现了低碳经济,物质的量相同的乙醇与汽油(设为C8H18)均完全燃烧产生的CO2的物质的量之比为 ;人们已尝试使用 作为汽车燃料可真正实现“二氧化碳零排放”.
(2)上海世博为实现环保世博、生态世博目标,如日本馆的超轻“膜结构”,能发电,会呼吸;澳大利亚馆外表,覆盖着比不锈钢更便宜耐用的“耐候钢”.因此材料是人类赖以生存和发展的重要物质基础.
①2010年上海世博会中国馆“东方之冠”的主体结构是用国产Q460钢制成的. 下列有关Q460钢的性质中,属于化学性质的是
A.强度高 B.能导电 C.耐腐蚀 D.抗震性好
②耐候钢看起来有些锈迹斑斑,再仔细一瞧却是光滑如新,这得益于耐候钢在大气中具有优良的抗蚀性能.请你列举两种防止铁制品被腐蚀的方法 、 .
③石英玻璃化学稳定性强、膨胀系数小,是一种特种玻璃,石英玻璃的主要成分是 (填化学式);有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种 (选填“橡胶”或“纤维”或“塑料”).
④日本馆的超轻“膜结构”,这层膜白天能透过阳光,利用太阳能发电,从而实现了将 转化为 .
查看习题详情和答案>>
2010年第41届世博会在上海成功举办,其主题是“城市,让生活更美好”.
(1)低碳经济是以低能耗、低污染、低排放为基础的经济模式,上海世博会的亮点之一是实现“二氧化碳零排放”.
①世博停车场,安装有汽车尾气催化光解设施,它能将汽车尾气中CO和NOx反应生成可参与大气生态环境循环的无毒气体,写出CO和NO在一定条件下反应的化学方程式:
②使用传统催化剂,使二氧化碳与某些有机物反应可以生成塑料,但反应时间长.目前诞生的纳米级催化剂增加了催化剂的表面积,提高了
③合理利用二氧化碳,可以提高生活质量,促进工业发展.在常压下,-78℃时,二氧化碳气体凝结成固态二氧化碳,俗称干冰.某学生买回一盒冰淇淋月饼,盒里有很多作为致冷剂的碎干冰.下列关于干冰处理的正确做法是
(A)将干冰放入冰箱 (B)让干冰在通风处自然升华
(C)直接将干冰倒入下水道 (D)用手取干冰扔入废物箱
④现在人们使用乙醇汽油作为汽车燃料充分体现了低碳经济,物质的量相同的乙醇与汽油(设为C8H18)均完全燃烧产生的CO2的物质的量之比为
(2)上海世博为实现环保世博、生态世博目标,如日本馆的超轻“膜结构”,能发电,会呼吸;澳大利亚馆外表,覆盖着比不锈钢更便宜耐用的“耐候钢”.因此材料是人类赖以生存和发展的重要物质基础.
①2010年上海世博会中国馆“东方之冠”的主体结构是用国产Q460钢制成的. 下列有关Q460钢的性质中,属于化学性质的是
A.强度高 B.能导电 C.耐腐蚀 D.抗震性好
②耐候钢看起来有些锈迹斑斑,再仔细一瞧却是光滑如新,这得益于耐候钢在大气中具有优良的抗蚀性能.请你列举两种防止铁制品被腐蚀的方法
③石英玻璃化学稳定性强、膨胀系数小,是一种特种玻璃,石英玻璃的主要成分是
④日本馆的超轻“膜结构”,这层膜白天能透过阳光,利用太阳能发电,从而实现了将
Ⅰ.某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H2O2的分解反应.
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
①从设计原理看,实验中的待测数据是
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]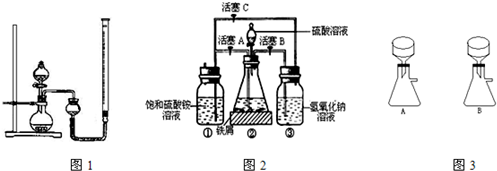
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
+5Fe2++8H+=Mn2++5Fe3++4H2O
试求产品中摩尔盐的质量分数
查看习题详情和答案>>
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,
干燥
干燥
,然后研细;⑤检查④中洗涤是否完全的操作是取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净
取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净
.(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
相同时间内产生气体的体积(或产生相同体积气体所需要的时间)
相同时间内产生气体的体积(或产生相同体积气体所需要的时间)
.②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.
CuO的质量在反应前后是否发生改变
CuO的质量在反应前后是否发生改变
.Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]

在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞
A
A
,打开活塞B、C
B、C
(填字母).向容器①中通入氢气的目的是赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+
赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+
.(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是
A
A
.(填A或B)(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
- 4 |
试求产品中摩尔盐的质量分数
80%
80%
.(NH4)2SO4?FeSO4?6H2O的相对分子质量为392.已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定.以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图.根据下图回答:

(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):
(4)步骤3中,加入(NH4)2SO4固体后,应加热到
(5)抽滤装置的仪器有:
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法.
称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mol/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00mL.
①请完成滴定过程中发生的离子方程式:
②本实验的指示剂
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于
④终点颜色的变化:
⑤产品中Fe2+的质量分数为
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:
查看习题详情和答案>>

(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:
CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
. HCO3-+OH-
HCO3-+OH-(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有
AB
AB
:A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.步骤2中溶液趁热过滤的原因是防止溶液冷却时,硫酸亚铁因析出而损失
防止溶液冷却时,硫酸亚铁因析出而损失
.(4)步骤3中,加入(NH4)2SO4固体后,应加热到
溶液表面出现晶膜
溶液表面出现晶膜
时,停止加热.需经过的实验操作包括:蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
、减压过滤(或抽滤)等得到较为干燥
干燥
的晶体.(5)抽滤装置的仪器有:
布氏漏斗
布氏漏斗
、抽滤瓶
抽滤瓶
、安全瓶、抽气泵组成.(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法.
称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mol/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00mL.
①请完成滴定过程中发生的离子方程式:
5
5
Fe2++1
1
MnO4-+8H+
8H+
=1
1
Mn2++5
5
Fe3++4
4
H2O②本实验的指示剂
D
D
.A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于
酸式
酸式
(酸式、碱式)滴定管中④终点颜色的变化:
溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点
溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点
.⑤产品中Fe2+的质量分数为
14%
14%
.(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:
a<b<c
a<b<c
.(用a,b,c回答)