网址:http://m.1010jiajiao.com/timu3_id_433231[举报]
(14分)黄铜矿( CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)、若冶炼铜的反应为:8 CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
CuFeS2中Fe的化合价为+2,反应中被氧化的元素是___________(填元素符号)。
(2)、上述冶炼过程中产生大量SO2,下列处理方案合理的是___________(填代号)。
a.高空排放 b.用于制备硫酸
c.用浓硫酸吸收 d.用纯碱溶液吸收制Na2SO3
(3)、采用火法熔炼工艺生产铜的中间过程会发生Cu2O与Cu2S在高温下转化为Cu,放出SO2气体的反应。若Cu2O和Cu2S正好完全反应,Cu2O和Cu2S的物质的量之比为_____;Cu2S和HNO3有如下反应:3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO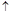 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
(4)、过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82-+2I—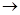 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
(14分)黄铜矿( CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)、若冶炼铜的反应为:8 CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
CuFeS2中Fe的化合价为+2,反应中被氧化的元素是___________(填元素符号)。
(2)、上述冶炼过程中产生大量SO2,下列处理方案合理的是___________(填代号)。
a.高空排放 b.用于制备硫酸
c.用浓硫酸吸收 d.用纯碱溶液吸收制Na2SO3
(3)、采用火法熔炼工艺生产铜的中间过程会发生Cu2O与Cu2S在高温下转化为Cu,放出SO2气体的反应。若Cu2O和Cu2S正好完全反应,Cu2O和Cu2S的物质的量之比为_____;Cu2S和HNO3有如下反应:3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
(4)、过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82-+2I— 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
查看习题详情和答案>>
(1)、若冶炼铜的反应为:8 CuFeS2+21O2
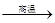 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2CuFeS2中Fe的化合价为+2,反应中被氧化的元素是___________(填元素符号)。
(2)、上述冶炼过程中产生大量SO2,下列处理方案合理的是___________(填代号)。
a.高空排放 b.用于制备硫酸
c.用浓硫酸吸收 d.用纯碱溶液吸收制Na2SO3
(3)、采用火法熔炼工艺生产铜的中间过程会发生Cu2O与Cu2S在高温下转化为Cu,放出SO2气体的反应。若Cu2O和Cu2S正好完全反应,Cu2O和Cu2S的物质的量之比为_____;Cu2S和HNO3有如下反应:3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO
 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。(4)、过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82-+2I—
 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
| ||
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol?L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3)
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×-20 | 4.0×10-38 |
铜在自然界存在于多种矿石中,如黄铜矿(CuFeS2)、辉铜矿(Cu2S)、孔雀石(CuCO3·Cu(OH)2)等。
(1)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,由黄铜矿冶炼铜的反应为:8 CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16 SO2。
① 在反应产物中加入过量的盐酸溶解,其溶液中含有的阳离子为 。
② 上述冶炼过程产生大量的SO2。某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告。
| 序号 | 二氧化硫的性质 | 主要操作和现象 | 化学方程式 | |||||
| Ⅰ | 将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 | |||||||
| Ⅱ | 氧化性[来源:学科网] | |||||||
| Ⅲ | 将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色色变为无色 | |||||||
| ||||||||
(2)孔雀石在一定条件F能发生分解反应,其产物有如下转化关系。E为相对分子质量为44且能和新制的氢氧化铜在加热下反应的化合物。

① D跟G反应的化学方程式为: :
② B和F反应的化学方程式为: 。
查看习题详情和答案>>