题目内容
25℃时,有关弱酸的电离平衡常数如下:
回答下列问题:
(1)等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则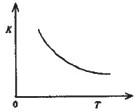 a
a
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
醋酸的电离程度将如何变化
电离平衡常数将如何变化
(4)合成氨发生的反应为N2+3H2 2NH3.400“C时,该反应平衡常数K=0.5mol-2.?L2.已知该反应的平衡常数与温度的关系如图所示.500℃时,在 0.5L的定容容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别是2mol、1mol,2mol,则此时反应 V(N2)正
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:
c(CN-)<c(HCO3-)<c(CH3COO-)
c(CN-)<c(HCO3-)<c(CH3COO-)
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则
 a
a<
<
b(填>、<、=)(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
先增大再减小
先增大再减小
醋酸的电离程度将如何变化
增大
增大
电离平衡常数将如何变化
不变
不变
(4)合成氨发生的反应为N2+3H2 2NH3.400“C时,该反应平衡常数K=0.5mol-2.?L2.已知该反应的平衡常数与温度的关系如图所示.500℃时,在 0.5L的定容容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别是2mol、1mol,2mol,则此时反应 V(N2)正
<
<
v(N2)逆(填>、<、=或不能确定).请书写判断理由Q=0.5,而500℃时K<o.5,Q<K,平衡往逆方向移动
Q=0.5,而500℃时K<o.5,Q<K,平衡往逆方向移动
.分析:(1)弱离子水解导致溶液显示一定的酸性和碱性越弱越电离;
(2)根据盐的水解知识来回答;
(3)在冰醋酸中逐滴加水,醋酸先电离,然后相当于将醋酸稀释的过程;
(4)根据浓度熵和平衡常数的关系来计算回答;
(2)根据盐的水解知识来回答;
(3)在冰醋酸中逐滴加水,醋酸先电离,然后相当于将醋酸稀释的过程;
(4)根据浓度熵和平衡常数的关系来计算回答;
解答:解:( 1)根据CH3COOH、HCN、c(CN-)、H2CO3的电离平衡常数,可以知道酸性顺序是:CH3COOH>H2CO3>HCN,所以水解程度:CN->HCO3->CH3COO-,所以等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:c(CN-)<c(HCO3-)<c(CH3COO-),故答案为:c(CN-)<c(HCO3-)<c(CH3COO-);
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,二者相互反应,生成NaCN,CN-会水解,如果所得溶液中c(Na+)=c(CN-),则需要:a<b,故答案为:<;
(3)在冰醋酸中逐滴加水,醋酸先溶解并电离,电离程度逐渐增大,离子浓度先增大,到后期,将冰醋酸稀释,离子浓度减小,则溶液的导电性将减小,电离平衡常数是温度的函数,K受温度的影响,温度不变则K不变,故答案为:先增大再减小; 增大;不变;
(4)当N2、H2、NH3的物质的量浓度分别是4mol、2mol,4mol,则Qc=
=
=0.5,知道合成氨发生的反应为放热反应,400℃时,该反应平衡常数K=0.5mol-2.?L2,温度越高,则K越小,所以Q>k,平衡往逆方向移动,故答案为:<;Q=0.5,而500℃时K<0.5,Q<K,平衡往逆方向移动.
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,二者相互反应,生成NaCN,CN-会水解,如果所得溶液中c(Na+)=c(CN-),则需要:a<b,故答案为:<;
(3)在冰醋酸中逐滴加水,醋酸先溶解并电离,电离程度逐渐增大,离子浓度先增大,到后期,将冰醋酸稀释,离子浓度减小,则溶液的导电性将减小,电离平衡常数是温度的函数,K受温度的影响,温度不变则K不变,故答案为:先增大再减小; 增大;不变;
(4)当N2、H2、NH3的物质的量浓度分别是4mol、2mol,4mol,则Qc=
| C(NH3)2 |
| C(N2)?C(H2)3 |
| 42 |
| 4×23 |
点评:本题考查学生盐的水解以及化学平衡的移动知识,可以根据所学内容来回答.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
已知25℃时,有关弱酸的电离平衡常数:
|