摘要: (根据肇庆市2011届高三级第一次模拟试题改编) 请回答下列问题: (1)现代工业将煤炭气化.既可以提高燃料的利用率.减少CO.SO2等的排放.又可以扩大水煤气的广泛用途. ①已知:2C(s)+O2(g)=2CO(g),ΔH1 , 2H2(g)+O2(g)=2H2O(g),ΔH2 . 则反应C(s)+H2O(g) CO(g)+H2(g),ΔH= .(用含ΔH1.ΔH2的代数式表示) ②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g),ΔH3.现在容积均为1L的a.b.c.d.e五个密闭容器中分别充入1mol CO和2mol H2的混合气体.控温.进行实验.测得相关数据如下图1和图2.ww.k@s@5@ 高#考#资#源#网 a. 该反应的ΔH3 0(选填“< .“> 或“= .下同).K1 K2. b. 将容器d中的平衡状态转变到容器c中的平衡状态.可采取的措施有 . (2)利用电解实验可以制得纯净的Fe(OH)2白色沉淀.如图所示.已知两电极的材料分别为石墨和铁. (a)a电极反应式为 . (b)电解液c可以是 . A.纯水 B.NaCl溶液 C.H2SO4溶液 D.CuCl2溶液 (3)右图为某温度下.Fe(OH)32(s)分别在溶液中达到沉淀溶解平衡后.改变溶液的pH.金属阳离子浓度变化情况.据图分析: 该温度下.溶度积常数的关系为:Ksp[ Fe(OH)3] Ksp[Mg(OH)2] ,如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+.振荡后.白色沉淀会全部转化为红褐色沉淀.原因是 .
网址:http://m.1010jiajiao.com/timu3_id_432477[举报]
(2011?海南)硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2 向处理过的铁屑中加入过量的3mol?L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是
(3)在步骤3中,“一系列操作”依次为
(4)本实验制的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+常用的试剂是
查看习题详情和答案>>
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2 向处理过的铁屑中加入过量的3mol?L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有
②④⑤
②④⑤
(填仪器编号)①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是
抑制亚铁离子的水解
抑制亚铁离子的水解
;(3)在步骤3中,“一系列操作”依次为
加热浓缩
加热浓缩
、冷却结晶
冷却结晶
和过滤;(4)本实验制的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+常用的试剂是
KSCN溶液
KSCN溶液
,可以观察到得现象是溶液显血红色
溶液显血红色
.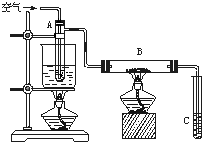 某课外活动小组用如图所示进行乙醇的催化氧化实验探究,试管A中盛有无水乙醇,B中装有CuO(用石棉绒作载体),试管C中放的是蒸馏水.请回答下列问题:
某课外活动小组用如图所示进行乙醇的催化氧化实验探究,试管A中盛有无水乙醇,B中装有CuO(用石棉绒作载体),试管C中放的是蒸馏水.请回答下列问题:(1)向试管A中鼓入空气的目的是
(2)玻璃管B中可观察到的现象是
相关化学方程式是
(3)在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是
(4)烧杯中水的作用是
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
2PbSO4+2H2O,现设计如图1所示装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减小11.2g.请回答下列问题:

(1)A是铅蓄电池的
(2)Ag电极上的反应式为
(3)Cu电极上的反应式为
(4)如图2表示电解时某个量(纵坐标x)随时间变化的曲线,这个量x最有可能表示的是
a.两个U形管中析出的气体体积
b.两个U形管中阳极质量的减少量
c.两个U形管中阴极质量的增加量.
查看习题详情和答案>>
| 放电 | 充电 |

(1)A是铅蓄电池的
负
负
(填“正”或“负”)极,铅蓄电池的正极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O
PbO2+4H++SO42-+2e-═PbSO4+2H2O
.(2)Ag电极上的反应式为
2H++2e-═H2↑
2H++2e-═H2↑
,析出的物质共0.4
0.4
g.(3)Cu电极上的反应式为
Cu-2e-═Cu2+
Cu-2e-═Cu2+
,CuSO4溶液的浓度不变
不变
(填“减小”、“增大”或“不变”).(4)如图2表示电解时某个量(纵坐标x)随时间变化的曲线,这个量x最有可能表示的是
b
b
(填序号).a.两个U形管中析出的气体体积
b.两个U形管中阳极质量的减少量
c.两个U形管中阴极质量的增加量.
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回 流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.
请回答下列问题:
(1)写出生成乙酸乙酯的反应方程式:
(2)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:

则试剂a是:
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来.实验结果:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质.你认为甲、乙两位的同学的做法:
A.甲正确 B.乙正确 C.甲乙均不正确 D.甲乙均正确
理由是:
查看习题详情和答案>>
请回答下列问题:
(1)写出生成乙酸乙酯的反应方程式:
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
| 浓硫酸 |
| 加热 |
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
.| 浓硫酸 |
| 加热 |
(2)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入
碎瓷片
碎瓷片
,目的是防止烧瓶中液体暴沸
防止烧瓶中液体暴沸
.(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:

则试剂a是:
饱和碳酸钠溶液
饱和碳酸钠溶液
,分离方法I是分液
分液
,试剂b是硫酸
硫酸
,分离方法III是蒸馏
蒸馏
.(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来.实验结果:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质.你认为甲、乙两位的同学的做法:
C
C
A.甲正确 B.乙正确 C.甲乙均不正确 D.甲乙均正确
理由是:
甲所加NaOH溶液较少,没有将余酸中和;乙所加NaOH溶液过量,使酯完全水解
甲所加NaOH溶液较少,没有将余酸中和;乙所加NaOH溶液过量,使酯完全水解
.三农问题是政府和社会关注的问题,化肥是土地的营养品.某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为
A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为
×100%
×100%.(不需要化简)
查看习题详情和答案>>
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容
以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL)
以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL)
,写出实验步骤④中的离子方程式:OH-+H+═H2O
OH-+H+═H2O
.(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
AC
AC
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是
减小误差,提高实验结果的准确度
减小误差,提高实验结果的准确度
.(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为
C
C
(填字母选项).A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |