摘要:[改编] 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀. 甲同学认为两者反应生成只有CuCO3一种沉淀,乙同学认为这两者相互促进水解反应.生成Cu(OH)2一种沉淀,丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水) Ⅰ在探究沉淀物成分前.须将沉淀从溶液中分离并净化.具体操作为①过滤②洗涤③干燥. Ⅱ.请用下图所示装置.选择必要的试剂.定性探究生成物的成分. ⑴各装置连接顺序为 → → .⑵装置C中装有试剂的名称是 ▲ . ⑶能证明生成物中有CuCO3的实验现象是 ▲ . Ⅲ.若CuCO3和Cu(OH)2两者都有.可通过下列所示装置的连接.进行定量分析来测定其组成. ⑴ 实验开始时要通入过量的空气其作用是 ▲ . ⑵若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为: ▲ . 命题意图:考查化学实验室常用仪器的主要用途和使用方法,能识别典型的实验装置图,实验室常用试剂的使用和保存方法.
网址:http://m.1010jiajiao.com/timu3_id_432465[举报]
 有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.
有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.【探究目的】实验测定样品中NaHCO3和KHCO3物质的量之比.
【探究思路】设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质的量之比.
【实验探究】实验装置如图甲所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).
如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积为
V2-V1
V2-V1
mL.写出锥形瓶中反应的离子方程式HCO3-+H+=H2O+CO2↑
HCO3-+H+=H2O+CO2↑
.【结果处理】锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体体积(已换算成标准状况)与加入的稀硫酸的体积关系如图乙所示:
(1)实验所用稀硫酸中溶质的物质的量浓度是
1
1
mol/L.(2)样品中NaHCO3和KHCO3物质的量之比为
5:3
5:3
.【拓展探究】某同学设计了另一种方案,其操作流程如图丙:在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHCO3和KHCO3物质的量之比
偏大
偏大
(选填“偏大”、“偏小”或“不变”).(1)某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、配制溶液时,若在最后一次读数时俯视读数,则导致最后实验结果偏大.
F、中和滴定时,若在最后一次读数时俯视读数,则导致最后实验结果偏大.
(2)常温下,已知0.1mol?L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8.
①常温下,0.1mol?L-1 HA溶液的pH=
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:
③0.2mol?L-1HA溶液与0.1mol?L-1NaOH溶液等体积混合后所得溶液中:
c(H+)+c(HA)-c(OH-)=
(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=
①该温度下(t℃),将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:
查看习题详情和答案>>
ABD
ABD
.A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、配制溶液时,若在最后一次读数时俯视读数,则导致最后实验结果偏大.
F、中和滴定时,若在最后一次读数时俯视读数,则导致最后实验结果偏大.
(2)常温下,已知0.1mol?L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8.
①常温下,0.1mol?L-1 HA溶液的pH=
3
3
;写出该酸(HA)与NaOH溶液反应的离子方程式:HA+OH-═A-+H2O
HA+OH-═A-+H2O
;②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:
c(A-)>c(Na+)>c(H+)>c(OH-)
c(A-)>c(Na+)>c(H+)>c(OH-)
;③0.2mol?L-1HA溶液与0.1mol?L-1NaOH溶液等体积混合后所得溶液中:
c(H+)+c(HA)-c(OH-)=
0.05
0.05
mol?L-1.(溶液体积变化忽略不计)(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=
1.0×10-13
1.0×10-13
.①该温度下(t℃),将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
12
12
.②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:
pHa+pHb=12
pHa+pHb=12
.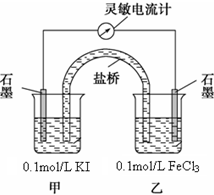 某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.
某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.按要求回答下列问题.
方案甲:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,再继续加入2mL CCl4,充分振荡.静置、分层,再取上层清液,滴加KSCN溶液.
(1)甲方案中能证明该反应为可逆反应的现象是
(2)有同学认为该方案设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是
方案乙:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,溶液呈棕黄色,再往溶液中滴加NH4F溶液,若看到
方案丙:
设计如图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零.
当指针读数变零后,在乙烧杯中加入1mol/L FeCl2溶液,若观察到灵敏电流计的指针向
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2,已知:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol H2O(g)═H2O(l)△H=-44.0KJ/mol
(1)1mol氢气燃烧生成液态水时放出的热量为
(2)写出CO和 H2O(g)作用生成CO2和H2的热化学方程式 .
(3)往1L体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“变小”或“不变”),平衡将向 (填“正”或“逆”)反应方向移动.
(4)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 .
查看习题详情和答案>>
(1)1mol氢气燃烧生成液态水时放出的热量为
(2)写出CO和 H2O(g)作用生成CO2和H2的热化学方程式
(3)往1L体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为
(4)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
(2010?和平区一模)Ⅰ.某化学兴趣小组探究饱和氯水与石灰石的反应,并制取较浓的HClO溶液和对所得溶液中的部分阴离子进行检验.
(1)用平衡移动的观点解释石灰石溶解氯水的原因
(2)步骤2、步骤3的实验目的都是
(3)请你设计-个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组按以下步骤制取摩尔盐:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离;
②用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与[(NH4)2SO4溶液混合,结晶得到摩尔盐.
试回答下列问题:
(1)如何从溶液中分解出摩尔盐?
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
(3)为了确定产品中亚铁离子的含量,某研究小组用KMnO4酸性溶液进行滴定,请写出该反应的离子方程式:
(4)现有等浓度的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液,其中c(NH4+)由大到小的顺序是:
查看习题详情和答案>>
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
将石灰石放在水中有CaCO3(S)=Ca2+(aq)+CO32-(aq)平衡存在,氯水中存在Cl2+H2O?H++Cl-+HClO平衡,加入到氯水中又有2H++CO32-=H2O+CO2↑发生,H+-的浓度减少,平衡正向移动,石灰石溶解了氯水
将石灰石放在水中有CaCO3(S)=Ca2+(aq)+CO32-(aq)平衡存在,氯水中存在Cl2+H2O?H++Cl-+HClO平衡,加入到氯水中又有2H++CO32-=H2O+CO2↑发生,H+-的浓度减少,平衡正向移动,石灰石溶解了氯水
.(2)步骤2、步骤3的实验目的都是
检验HCO3-离子
检验HCO3-离子
,为达到该实验目的,还可以采取的方法是另取一份滤液,加入NaOH溶液,观察有无沉淀产生
另取一份滤液,加入NaOH溶液,观察有无沉淀产生
.(3)请你设计-个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:
同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
.Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组按以下步骤制取摩尔盐:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离;
②用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与[(NH4)2SO4溶液混合,结晶得到摩尔盐.
试回答下列问题:
(1)如何从溶液中分解出摩尔盐?
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
(3)为了确定产品中亚铁离子的含量,某研究小组用KMnO4酸性溶液进行滴定,请写出该反应的离子方程式:
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
.(4)现有等浓度的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液,其中c(NH4+)由大到小的顺序是:
③②①
③②①
(填序号).