题目内容
(2010?和平区一模)Ⅰ.某化学兴趣小组探究饱和氯水与石灰石的反应,并制取较浓的HClO溶液和对所得溶液中的部分阴离子进行检验.
(1)用平衡移动的观点解释石灰石溶解氯水的原因
(2)步骤2、步骤3的实验目的都是
(3)请你设计-个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组按以下步骤制取摩尔盐:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离;
②用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与[(NH4)2SO4溶液混合,结晶得到摩尔盐.
试回答下列问题:
(1)如何从溶液中分解出摩尔盐?
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
(3)为了确定产品中亚铁离子的含量,某研究小组用KMnO4酸性溶液进行滴定,请写出该反应的离子方程式:
(4)现有等浓度的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液,其中c(NH4+)由大到小的顺序是:
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
将石灰石放在水中有CaCO3(S)=Ca2+(aq)+CO32-(aq)平衡存在,氯水中存在Cl2+H2O?H++Cl-+HClO平衡,加入到氯水中又有2H++CO32-=H2O+CO2↑发生,H+-的浓度减少,平衡正向移动,石灰石溶解了氯水
将石灰石放在水中有CaCO3(S)=Ca2+(aq)+CO32-(aq)平衡存在,氯水中存在Cl2+H2O?H++Cl-+HClO平衡,加入到氯水中又有2H++CO32-=H2O+CO2↑发生,H+-的浓度减少,平衡正向移动,石灰石溶解了氯水
.(2)步骤2、步骤3的实验目的都是
检验HCO3-离子
检验HCO3-离子
,为达到该实验目的,还可以采取的方法是另取一份滤液,加入NaOH溶液,观察有无沉淀产生
另取一份滤液,加入NaOH溶液,观察有无沉淀产生
.(3)请你设计-个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:
同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
.Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组按以下步骤制取摩尔盐:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离;
②用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与[(NH4)2SO4溶液混合,结晶得到摩尔盐.
试回答下列问题:
(1)如何从溶液中分解出摩尔盐?
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
(3)为了确定产品中亚铁离子的含量,某研究小组用KMnO4酸性溶液进行滴定,请写出该反应的离子方程式:
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
.(4)现有等浓度的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液,其中c(NH4+)由大到小的顺序是:
③②①
③②①
(填序号).分析:Ⅰ.(1)根据生成物浓度减少对化学平衡的影响;
(2)根据碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,溶液中存在HCO3-,加入盐酸生成二氧化碳气体,加入NaOH有碳酸钙沉淀生成;
(3)HClO的浓度越大,漂白效果会越好;
Ⅱ.(1)根据可溶物溶质的分离方法:加热浓缩溶液,然后冷却结晶过滤;
(2)根据遇KSCN溶液呈血红色是Fe3+的特征反应,所以先加KSCN溶液,确定是否含有Fe3+;如果没有Fe3+,根据氯水的性质,再向溶液中加入氯水,观察溶液的颜色是否变化,从而确定是否含有Fe2+;
(3)据氧化还原反应化合价确定产物,然后根据电子守恒、电荷守恒、原子守恒配平写出离子方程式;
(4)加入与原水解离子的水解性质相同的,对原水解离子有抑制作用;加入与原水解离子的水解性质相反的,对原水解离子有促进作用.
(2)根据碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,溶液中存在HCO3-,加入盐酸生成二氧化碳气体,加入NaOH有碳酸钙沉淀生成;
(3)HClO的浓度越大,漂白效果会越好;
Ⅱ.(1)根据可溶物溶质的分离方法:加热浓缩溶液,然后冷却结晶过滤;
(2)根据遇KSCN溶液呈血红色是Fe3+的特征反应,所以先加KSCN溶液,确定是否含有Fe3+;如果没有Fe3+,根据氯水的性质,再向溶液中加入氯水,观察溶液的颜色是否变化,从而确定是否含有Fe2+;
(3)据氧化还原反应化合价确定产物,然后根据电子守恒、电荷守恒、原子守恒配平写出离子方程式;
(4)加入与原水解离子的水解性质相同的,对原水解离子有抑制作用;加入与原水解离子的水解性质相反的,对原水解离子有促进作用.
解答:解:Ⅰ.(1)石灰石水存在溶解平衡:CaCO3(S)=Ca2+(aq)+CO32-(aq),氯水中存在平衡:Cl2+H2O?H++Cl-+HClO,加入到氯水中又有发生:2H++CO32-=H2O+CO2↑,H+-的浓度减少,平衡正向移动,
故答案为:将石灰石放在水中有CaCO3(S)=Ca2+(aq)+CO32-(aq)平衡存在,氯水中存在Cl2+H2O?H++Cl-+HClO平衡,加入到氯水中又有2H++CO32-=H2O+CO2↑发生,H+-的浓度减少,平衡正向移动,石灰石溶解了氯水;
(2)因为碳酸钙是过量的,碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,溶液中存在HCO3-,加入盐酸生成二氧化碳气体,加热时碳酸氢钙分解生成CaCO3和CO2,加入NaOH有碳酸钙沉淀生成,
故答案为:检验HCO3-离子;另取一份滤液,加入NaOH溶液,观察有无沉淀产生;
(3)HClO的浓度越大,漂白效果会越好,可同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢,
故答案为:同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢;
Ⅱ.(1)将溶液加热浓缩,然后冷却结晶过滤,可得摩尔,故答案为:小心加热浓缩溶液,然后冷却结晶过滤;
(2)将少许所得晶体放入KSCN溶液不变色,说明没有Fe3+,再向溶液中加入氯水后变成血红色,则含有Fe2+,
故答案为:将少许所得晶体放入KSCN溶液不变色,再向溶液中加入氯水后变成血红色;
(3)亚铁离子和KMnO4酸性溶液反应得到Fe3+,Mn2+,MnO4-中锰由+7价降为+2价,得到5个电子,Fe2+中铁由+2升高到+3价,失去1个电子,依据电子守恒,亚铁离子前乘5,MnO4-前乘1,依据原子守恒和电荷守恒得到反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(4)在三种溶液中铵根离子均会水解,铵根离子水解呈酸性.在(NH4)2CO3溶液中,由于碳酸根离子水解呈碱性,因此碳酸根离子的存在会促进铵根离子的水解,c(NH4+)增大,在(NH4)2Fe(SO4)2溶液中,由于亚铁离子水解也呈酸性,因此亚铁离子的存在会抑制铵根离子的水解,平衡向左移动,c(NH4+)减少,所以c(NH4+)由大到小的顺序③②①,故答案为:③②①.
故答案为:将石灰石放在水中有CaCO3(S)=Ca2+(aq)+CO32-(aq)平衡存在,氯水中存在Cl2+H2O?H++Cl-+HClO平衡,加入到氯水中又有2H++CO32-=H2O+CO2↑发生,H+-的浓度减少,平衡正向移动,石灰石溶解了氯水;
(2)因为碳酸钙是过量的,碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,溶液中存在HCO3-,加入盐酸生成二氧化碳气体,加热时碳酸氢钙分解生成CaCO3和CO2,加入NaOH有碳酸钙沉淀生成,
故答案为:检验HCO3-离子;另取一份滤液,加入NaOH溶液,观察有无沉淀产生;
(3)HClO的浓度越大,漂白效果会越好,可同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢,
故答案为:同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢;
Ⅱ.(1)将溶液加热浓缩,然后冷却结晶过滤,可得摩尔,故答案为:小心加热浓缩溶液,然后冷却结晶过滤;
(2)将少许所得晶体放入KSCN溶液不变色,说明没有Fe3+,再向溶液中加入氯水后变成血红色,则含有Fe2+,
故答案为:将少许所得晶体放入KSCN溶液不变色,再向溶液中加入氯水后变成血红色;
(3)亚铁离子和KMnO4酸性溶液反应得到Fe3+,Mn2+,MnO4-中锰由+7价降为+2价,得到5个电子,Fe2+中铁由+2升高到+3价,失去1个电子,依据电子守恒,亚铁离子前乘5,MnO4-前乘1,依据原子守恒和电荷守恒得到反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(4)在三种溶液中铵根离子均会水解,铵根离子水解呈酸性.在(NH4)2CO3溶液中,由于碳酸根离子水解呈碱性,因此碳酸根离子的存在会促进铵根离子的水解,c(NH4+)增大,在(NH4)2Fe(SO4)2溶液中,由于亚铁离子水解也呈酸性,因此亚铁离子的存在会抑制铵根离子的水解,平衡向左移动,c(NH4+)减少,所以c(NH4+)由大到小的顺序③②①,故答案为:③②①.
点评:本题以较浓的HClO溶液、莫尔盐的制备为载体,考查了离子的检验、物质分离提纯等实验操作、氧化还原反应滴定应用,离子浓度大小比较,以及在新情境下综合运用知识解决问题的能力等.题目有一定的难度.需学生具有扎实的基础知识与灵活运用知识解决问题的能力.

练习册系列答案
相关题目
 (2010?和平区一模)阿斯巴甜(Aspartame)具有清爽的甜味,甜度约为蔗糖的200倍.有关说法不正确的是( )
(2010?和平区一模)阿斯巴甜(Aspartame)具有清爽的甜味,甜度约为蔗糖的200倍.有关说法不正确的是( )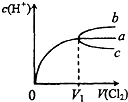 (2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
(2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )