题目内容
过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还 可以作为鱼池增氧剂。査阅文献:过氧化钙的制备方法一般有两种方案。利用CaCl2在碱性条件下与H2O2反应或者利用Ca(OH)2的NH4Cl溶液与H2O2反应,均可得到CaO2·8H2O沉淀。已知CaO2·8H2O呈白色,微溶于水,在60℃下烘0.5小时可形成CaO2·2H2O,再在 140℃下烘0.5小时,得无水CaO2。加热至350℃左右开始分解放出氧气。
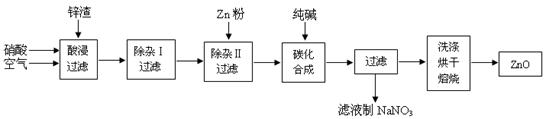
已知某化工厂生产过氧化钙的主要工艺流程如下:

某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量。
(1)用上述方法制取CaO2·8H2O的化学方程式是: 。
(2)检验“水洗”是否合格的方法是: 。
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
② 。
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体, 再滴入少量2mol/L的硫酸溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32—=2I—+ S4O62—】
①上述第三步滴定至终点,现象为 。
②CaO2的质量分数为 (用字母表示)
已知某化工厂生产过氧化钙的主要工艺流程如下:

某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量。
(1)用上述方法制取CaO2·8H2O的化学方程式是: 。
(2)检验“水洗”是否合格的方法是: 。
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
② 。
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体, 再滴入少量2mol/L的硫酸溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32—=2I—+ S4O62—】
①上述第三步滴定至终点,现象为 。
②CaO2的质量分数为 (用字母表示)
(1)CaCl2+H2O2+2NH3+8H2O = CaO2·8H2O↓+2NH4Cl (3分)
(2)取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。(2分)
(3)②温度低可减少过氧化氢的分解,提高过氧化氢的利用率。(2 分)
(4)①最后一滴Na2S2O3溶液滴下时,溶液蓝色刚好褪去,且30s内(或半分钟内)不恢复蓝色(2 分)
②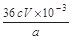 (3分)
(3分)
(2)取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。(2分)
(3)②温度低可减少过氧化氢的分解,提高过氧化氢的利用率。(2 分)
(4)①最后一滴Na2S2O3溶液滴下时,溶液蓝色刚好褪去,且30s内(或半分钟内)不恢复蓝色(2 分)
②
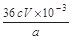 (3分)
(3分)试题分析:
(1)根据题意,CaCl2在碱性条件下和H2O2反应,利用CaO2?H2O溶解度不大而析出。
(2)检验“洗涤”是否合格,需要取最后一次洗涤液,检验其中是否存在杂质离子Cl-。
(3)反应时需要用的H2O2,因此反应温度不能过高。
(4)根据电子转移守恒关系可知:
CaO2 ~ I2 ~ 2S2O32-
m c×V×10-3mol
因此m%=
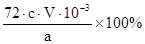

练习册系列答案
相关题目