��Ŀ����
�о�̼���仯��������ʡ���;���зdz���Ҫ�����塣
(1)�ڳ����£�̼��ʹ�����ĵ��볣�����±���ʾ��
(1)�ڳ����£�̼��ʹ�����ĵ��볣�����±���ʾ��

д��NaClO��Һ������CO2��Ӧ�����ӷ���ʽ��_________��
(2)�״���Ŀǰ�ƹ㳵��ȼ�ϣ������ʿ�����Ȼ������Ҫ�ɷ�ΪCH4���ϳɡ�
2CH4(g)+O2(g)=2CO(g)+4H2(g) ��H1=-71kJ/mol��
CO(g)+2H2(g)=CH3OH(l) ��H2=-90.5 kJ/mol��
CH4(g)+O2(g)=CH3OH(l) ��H3=_____kJ/mol��
��ʾ�÷�Ӧ�����е������仯��������____��ѡ����ͼ�е���š�I~��������
(2)�״���Ŀǰ�ƹ㳵��ȼ�ϣ������ʿ�����Ȼ������Ҫ�ɷ�ΪCH4���ϳɡ�
2CH4(g)+O2(g)=2CO(g)+4H2(g) ��H1=-71kJ/mol��
CO(g)+2H2(g)=CH3OH(l) ��H2=-90.5 kJ/mol��
CH4(g)+O2(g)=CH3OH(l) ��H3=_____kJ/mol��
��ʾ�÷�Ӧ�����е������仯��������____��ѡ����ͼ�е���š�I~��������

(3)ʵ������̼��ƺ�ϡ�ᷴӦ��ȡCO2��ѡȡ��ϡ����ϡ���������ϡ���ᣬ��ԭ���� ___��ѡ����ĸ���ţ���
a������е�ߣ����ڷǻӷ�����
b���������������
c��ϡ������̼��Ʒ�Ӧ�����ܵ�CaSO4
d��ϡ������̼��Ʒ�Ӧ���ܳ����ز���������̼
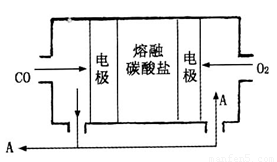
(4)ȼ�ϵ������ȼ��Ϊ��ȼ�����壬������COΪȼ�ϾͿ�������ԭ��أ����ֵ�ص�һ���缫��ͨ��O2����һ���缫��ͨ��CO������ʲ��õ�������̼���Σ��ɴ˿�֪��ȼ�ϵ�طŵ�ʱ�ĸ�����ӦʽΪ________�����ʹ�øõ�ص�ⱥ��ʳ��ˮ��ȡNaClO����ô����������1mol NaClO��Ҫ��״���µ����������Ϊ____L��
a������е�ߣ����ڷǻӷ�����
b���������������
c��ϡ������̼��Ʒ�Ӧ�����ܵ�CaSO4
d��ϡ������̼��Ʒ�Ӧ���ܳ����ز���������̼
(4)ȼ�ϵ������ȼ��Ϊ��ȼ�����壬������COΪȼ�ϾͿ�������ԭ��أ����ֵ�ص�һ���缫��ͨ��O2����һ���缫��ͨ��CO������ʲ��õ�������̼���Σ��ɴ˿�֪��ȼ�ϵ�طŵ�ʱ�ĸ�����ӦʽΪ________�����ʹ�øõ�ص�ⱥ��ʳ��ˮ��ȡNaClO����ô����������1mol NaClO��Ҫ��״���µ����������Ϊ____L��
(1)ClO-+CO2+H2O=HClO+HCO3-
(2) -126�� I
(3)cd
(4)CO+CO32--2e-=2CO2��11.2
(2) -126�� I
(3)cd
(4)CO+CO32--2e-=2CO2��11.2

��ϰ��ϵ�д�
�����Ŀ
 ��1����ҵ�Ͽ����÷�ӦNa��1��+ KCl��1��
K��g��+ NaCl��1�������������أ��˷�Ӧ�������ƵĻ�ԭ�Լ�___
_____��
��1����ҵ�Ͽ����÷�ӦNa��1��+ KCl��1��
K��g��+ NaCl��1�������������أ��˷�Ӧ�������ƵĻ�ԭ�Լ�___
_____��