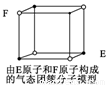
摘要:15.下列说法错误的是 ( ) A.从CH4.NH4+.SO42-为正四面体结构.可推测PH4+.PO43-也为正四面体结构 B.1mol金刚石晶体中.平均含有2mol C-C键 C.水的沸点比硫化氢的高.是因为H2O分子间存在氢键.H2S 分子间不能形成氢键 D.某气态团簇分子结构如右图所示.该气态团簇分子的分子 式为EF或FE [答案]D [解析]根据等电子体的概念可知选项A正确.金刚石中碳原子形成空间网状 的正四面体结构.故B正确.选项C显然是正确的.选项D中强调该物质 是气态团簇分子.即是一个大分子.因此不能用均摊法计算.直接找出分子中原子个数即得化学式. 该物质的化学式应为(EF)4.选项D错. [考点]物质结构与性质
网址:http://m.1010jiajiao.com/timu3_id_430672[举报]
下列说法错误的是( )
查看习题详情和答案>>
| A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 |
| B.1 mol金刚石晶体中,平均含有2 mol C-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
D.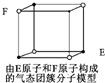 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
下列说法错误的是 ( )
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
 B.1mol金刚石晶体中,平均含有2mol C—C键
B.1mol金刚石晶体中,平均含有2mol C—C键
C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S
分子间不能形成氢键
D.某气态团簇分子结构如右图所示,该气态团簇分子的分子
式为EF或FE
查看习题详情和答案>>下列说法错误的是( )
| A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 |
| B.1 mol金刚石晶体中,平均含有2 mol C—C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
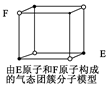
| D.某气态团簇分子结构如右图所示,该气态团簇分子的分子式为EF或FE |
 查看习题详情和答案>>
查看习题详情和答案>>