网址:http://m.1010jiajiao.com/timu3_id_42843[举报]
长期存放的Na2SO3会被空气中的氧气部分氧化:某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。
(Ⅰ)甲同学设计了下图实验
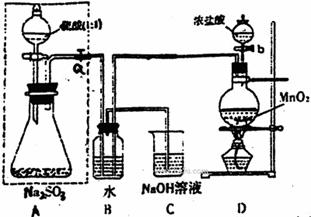
请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应如何检查虚线框内装置的气密性?
。
(2)写出B装置中的离子方程式 。
写出D装置中反应的化学方程式 。
(3)称量agNa2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaCl2溶液
充分反应,过滤、洗涤、干燥、称量得白色沉淀bg,则样品中Na2SO3的质量分数为 。
(4)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
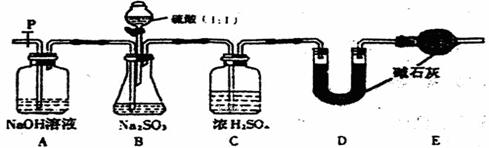 (Ⅱ)乙同学设计了另一套实验装置如下图:
(Ⅱ)乙同学设计了另一套实验装置如下图:
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 处,(填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液。
丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质
量分数。下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaCl2溶液,过滤、洗涤、干燥、称量得沉淀ml g
B.将样品溶解,加足量硝酸,再加足量BaCl2溶液、过滤、洗涤、干燥、称量得沉淀m2 g
C.将样品溶解,加过量BaCl2溶液,过滤后将溶液蒸干,称量得固体m3g
D.将样品溶解,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤,洗涤、干燥,称量得固体m4g。
查看习题详情和答案>>长期存放在Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测不定期某无水Na2SO3被氧化的程度。
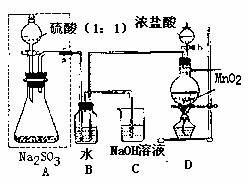
请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,是应如何检查虚线框内装置的气密性?
。
(2)写出B装置中反应的离子方程式 。
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(4)深入研究发现,是述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:
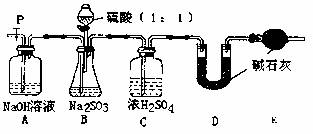
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO4样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(7)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将虑液蒸干,称量得固体m3g
D.将样品溶液,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
查看习题详情和答案>> 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:Ⅰ定性研究亚硫酸钠被氧化的程度
假设1:亚硫酸钠未被氧化;假设2:亚硫酸钠完全被氧化
假设3:
请设计实验方案证明假设3成立的操作步骤及实验现象
Ⅱ定量研究亚硫酸钠被氧化的程度
根据某同学设计的如下图装置回答下面的问题:
(1)B装置中反应的离子方程式为
(2)称量ag Na2SO3样品放入锥形瓶中,待A、B装置中都反应完全后,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分数为
| 126b |
| 233a |
| 126b |
| 233a |
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶实验室长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中Br2和Na2SO3反应的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,下表是某同学鉴定其中SO32-、SO42-和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制饱和氯水;品红溶液。
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤①
|
取少量待测液加入试管中,加入过量2mol·L-1HCl,再滴加适量1 mol·L-1BaCl2 溶液。 |
有白色沉淀生成,证明待测液中含有、SO42- 。 |
|
步骤②
|
|
|
|
步骤③
|
|
|
(3)为了测定上述样品的纯度,现取10.0克试样配成250ml溶液。取出25.00ml所配溶液,用0.10mol/L的酸性KMnO4溶液滴定至终点。反应离子方程式为:
重复操作三次,每次消耗0.10mol/L KMnO4溶液体积分别为20.02 ml、 20.00 ml和19.98 ml。(相对原子质量Na 23 S 32 O 16)
①计算样品中Na2SO3的质量分数为 。(结果保留3位有效数字)
②操作时,若未用0.10mol/L的酸性KMnO4溶液润洗滴定管,会导致测定结果 。(填“偏高”、“偏低”或“没有影响”)
查看习题详情和答案>>
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶实验室长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中Br2和Na2SO3反应的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,下表是某同学鉴定其中SO32-、SO42-和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制饱和氯水;品红溶液。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中,加入过量2mol·L-1HCl,再滴加适量1 mol·L-1BaCl2 溶液。 | 有白色沉淀生成,证明待测液中含有、SO42- 。 |
| 步骤② | | |
| 步骤③ | | |
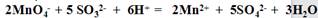
重复操作三次,每次消耗0.10mol/LKMnO4溶液体积分别为20.02 ml、 20.00 ml和19.98 ml。(相对原子质量Na 23 S 32 O 16)
①计算样品中Na2SO3的质量分数为 。(结果保留3位有效数字)
②操作时,若未用0.10mol/L的酸性KMnO4溶液润洗滴定管,会导致测定结果 。(填“偏高”、“偏低”或“没有影响”) 查看习题详情和答案>>
