摘要:A.B.C.D.E五种短周期元素.核电荷数依次增加.其中A与D同族,C与E同族,A的一种原子内无中子.B原子最外层电子数是内层电子数的2倍.一个C2-离子含10个电子. (1)我国普遍采取一种方法制取含有A.C.E三种元素的某重要化工产品.其工业生产的第一步反应方程式是: , (2)甲是由A.B.C三种元素组成的相对分子质量最小的物质.且可以发生银镜反应.甲的一种用途是 ,由甲中的两种元素组成.且与甲等电子的物质为乙.乙与水化合的产物与C的单质在KOH溶液中形成燃料电池的正极反应式为 . (3)D 与C形成的一种化合物具有强氧化性.这种化合物中阴离子与阳离子个数比为 , (4)均由A.C.D.E四种元素组成的两种物质丙和丁在溶液中反应离子方程式是: , (5)A与C能形成两种化合物.写出其中一种化合物转化为另一种化合物的化学方程式: 18 有:KIO3.KI.KBrO3.Br2.H2SO4.K2SO4和H2O (1)请将KIO3之外的反应物和生成物分别填入以下空格内: (2)其中被还原的元素是 ,氧化产物是 (3)将氧化剂和还原剂及其配平后系数填入下列空格中.并标出电子转移的方向和数目 (4)已知在同样条件下.KIO3能和KI反应生成I2.若在酸性溶液中混合KI.则反应后的氧化产物为 . 19某久置的FeCl2溶液略显黄色.同学认为可能有部分Fe2+被氧化成Fe3+ (1)请设计实验验证溶液中是否存在Fe3+ (2)若溶液中存在Fe3+.应如何除去? (3)若把溶液的Fe2+全部转化成Fe3+应该如何操作? 20. 请根据下图作答: 已知:一个碳原子上连有两个羟基时.易发生下列转化: (1) 反应①所属的有机反应类型是 反应. (2) 反应③的化学方程式 . (3) 已知B的相对分子质量为162.其完全燃烧的产物中n(CO2)∶n (H2O) = 2∶1.则B的分子式为 . (4) F是高分子光阻剂生产中的主要原料.F具有如下特点:①能跟FeCl3溶液发生显色反应,②能发生加聚反应,③苯环上的一氯代物只有两种.F在一定条件下发生加聚反应的化学方程式为 . (5) 化合物G是F的同分异构体.属于芳香族化合物.能发生银镜反应.G的结构有 种. (6) 化合物H是B的同分异构体.H分子中含有的部分结构为.它的水解产物经聚合反应后可得到高聚物(CaHbO2)n..H有多种结构.写出其中一种的结构简式 .
网址:http://m.1010jiajiao.com/timu3_id_425078[举报]
A、B、C、D、E五种短周期元素,核电荷数依次增大.A元素原子最外层p能级上只有一个轨道未填充电子.C、D的最外层电子排布相同,且二者核电荷数之和为24,B、C、E核外未成对电子数依次减少,E的核电荷数比D的核电荷数大1.请回答:
(1)写出元素名称:D
(2)上述各元素的气态氢化物中是非极性分子的有
(3)氢化物中
查看习题详情和答案>>
(1)写出元素名称:D
硫
硫
,E氯
氯
.(2)上述各元素的气态氢化物中是非极性分子的有
CH4
CH4
,C的氢化物中中心原子的杂化方式为sp3
sp3
,其在液态或固态时,分子间由于存在氢键
氢键
而使其熔、沸点及密度有特殊性.(3)氢化物中
NH3
NH3
和H2O
H2O
能与铜离子以配位键形成配位化合物,配位键的形成条件是一方提供孤电子对,另一方能提供空轨道
一方提供孤电子对,另一方能提供空轨道
.A、B、C、D、E五种短周期元素,核电荷数依次增加,其中B的最外层电子数是内层电子总数的2倍,它们可形成含有非极性键的B2A2、A2C2、D2C2的化合物;E的单质在自然界中常在火山喷口附近出现.据此回答下列问题:
(1)写出D2C2的电子式:

(2)我国普遍采用一种方法制得含有A、C、E三种元素的某重要化工产品,其工业生成的第一步化学反应方程式为
(3)均由A、C、D、E四种元素组成的两种物质在溶液中反应的离子方程式为
(4)由A与C两种元素组成的一种化合物能使酸性高锰酸钾褪色,反应的离子方程式是
(5)单质B可与由A、C、E 三种元素组成的化合物在一定条件下反应生成EC2,该反应的化学方程式为
(6)B元素的氢化物有多种,1molB的某种氢化物中含有14mol电子,已知在25℃,101kPa下,1g该气态氢化物在足量氧气中完全燃烧生成液态水时放出热量为50kJ,写出该物质燃烧热的热化学方程式
查看习题详情和答案>>
(1)写出D2C2的电子式:


(2)我国普遍采用一种方法制得含有A、C、E三种元素的某重要化工产品,其工业生成的第一步化学反应方程式为
4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
.
| ||
(3)均由A、C、D、E四种元素组成的两种物质在溶液中反应的离子方程式为
H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
.(4)由A与C两种元素组成的一种化合物能使酸性高锰酸钾褪色,反应的离子方程式是
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
.(5)单质B可与由A、C、E 三种元素组成的化合物在一定条件下反应生成EC2,该反应的化学方程式为
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
(6)B元素的氢化物有多种,1molB的某种氢化物中含有14mol电子,已知在25℃,101kPa下,1g该气态氢化物在足量氧气中完全燃烧生成液态水时放出热量为50kJ,写出该物质燃烧热的热化学方程式
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
| 5 |
| 2 |
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
.| 5 |
| 2 |
A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族.A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2-离子含10个电子.
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式: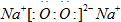
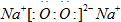 .
.
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式: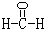
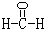 .
.
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
查看习题详情和答案>>
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式:
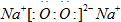
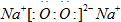
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式:
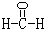
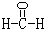
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
C2H2(g)+
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol
| 1 |
| 2 |
C2H2(g)+
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol
.| 1 |
| 2 |
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
C2H2-10e-+14OH-=2CO32-+8H2O
C2H2-10e-+14OH-=2CO32-+8H2O
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
.(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
2I-+H2O2+2H+=I2+2H2O
2I-+H2O2+2H+=I2+2H2O
.(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
.