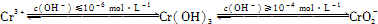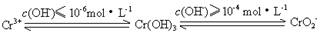题目内容
 含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知: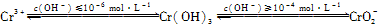
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.
①写出Cr2O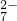 与FeSO4溶液在酸性条件下反应的离子方程式:______.
与FeSO4溶液在酸性条件下反应的离子方程式:______.
②用离子方程式表示溶液pH不能超过10的原因:______.
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O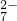 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去.
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去.
①写出阴极的电极反应式:______.
②电解法中加入氯化钠的作用是______.
(3)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
①CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的化学方程式为______.
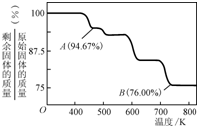
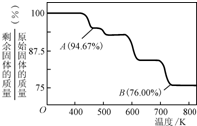
②CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时剩余固体的成分是______(填化学式).
解:(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为:Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
②由题意可知,当pH超过10即c(OH-)≥10-4mol?L-1时,Cr(OH)3转变成CrO2-:Cr(OH)3+OH-═CrO2-+2H2O,
故答案为:Cr(OH)3+OH-═CrO2-+2H2O;
(2)①将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阳极上铁失电子生成二价铁离子,阴极上氢离子得电子生成氢气,电极反应式为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,
故答案为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;
②水是弱电解质,所以蒸馏水的导电能力很小,氯化钠是强电解质,在水中能完全电离导致溶液阴阳离子浓度增大,所以能增强溶液导电性,故答案为:增强溶液导电性.
(3)①CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3CO0H+9H2O,
故答案为:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3CO0H+9H2O;
②设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×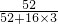 =52g,B点时固体的质量为:100g×76%=76g,Co的质量没有变,所以生成物中Co的质量为52g,氧元素的质量为16,两者的个数比为
=52g,B点时固体的质量为:100g×76%=76g,Co的质量没有变,所以生成物中Co的质量为52g,氧元素的质量为16,两者的个数比为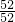 :
: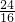 =2:3,所以B点时剩余固体的成分是Cr2O3,故答案为:Cr2O3.
=2:3,所以B点时剩余固体的成分是Cr2O3,故答案为:Cr2O3.
分析:(1)①二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,根据电子得失配平;
②由题意可知,当pH超过10即c(OH-)≥10-4mol?L-1时,Cr(OH)3转变成CrO2-,
(2)①阴极上氢离子放电生成氢气;
②水是弱电解质,导电性能较差,氯化钠是强电解质能增强水的导电性;
(3)①根据化合价升降总数相等以及原子守恒来解答;
②根据质量守恒定律,在变化过程中,Co的质量没有变,求出氧原子和铬原子的个数比即可;
点评:本题考查了离子方程式和电极反应式的书写,难度不大,注意(3)②题中,在变化过程中,Co的质量没有变,是解题的关键.
故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
②由题意可知,当pH超过10即c(OH-)≥10-4mol?L-1时,Cr(OH)3转变成CrO2-:Cr(OH)3+OH-═CrO2-+2H2O,
故答案为:Cr(OH)3+OH-═CrO2-+2H2O;
(2)①将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阳极上铁失电子生成二价铁离子,阴极上氢离子得电子生成氢气,电极反应式为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,
故答案为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;
②水是弱电解质,所以蒸馏水的导电能力很小,氯化钠是强电解质,在水中能完全电离导致溶液阴阳离子浓度增大,所以能增强溶液导电性,故答案为:增强溶液导电性.
(3)①CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3CO0H+9H2O,
故答案为:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3CO0H+9H2O;
②设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×
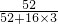 =52g,B点时固体的质量为:100g×76%=76g,Co的质量没有变,所以生成物中Co的质量为52g,氧元素的质量为16,两者的个数比为
=52g,B点时固体的质量为:100g×76%=76g,Co的质量没有变,所以生成物中Co的质量为52g,氧元素的质量为16,两者的个数比为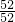 :
: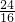 =2:3,所以B点时剩余固体的成分是Cr2O3,故答案为:Cr2O3.
=2:3,所以B点时剩余固体的成分是Cr2O3,故答案为:Cr2O3.分析:(1)①二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,根据电子得失配平;
②由题意可知,当pH超过10即c(OH-)≥10-4mol?L-1时,Cr(OH)3转变成CrO2-,
(2)①阴极上氢离子放电生成氢气;
②水是弱电解质,导电性能较差,氯化钠是强电解质能增强水的导电性;
(3)①根据化合价升降总数相等以及原子守恒来解答;
②根据质量守恒定律,在变化过程中,Co的质量没有变,求出氧原子和铬原子的个数比即可;
点评:本题考查了离子方程式和电极反应式的书写,难度不大,注意(3)②题中,在变化过程中,Co的质量没有变,是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.