网址:http://m.1010jiajiao.com/timu3_id_422733[举报]
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642.2kJ?mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1
H2O(l)=H2O(g)△H=44kJ?mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l) 的热化学方程式:
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含 H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如图1所示,再加热水解即可得H2O2和(NH4)2SO4.
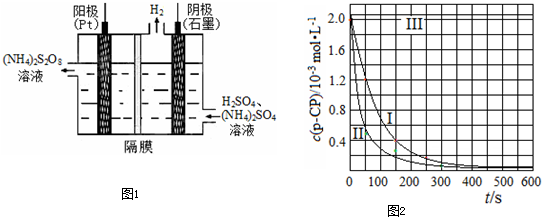
①电解时,阳极的电极方程式
②写出生成H2O2的反应的化学方程式:
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如图2所示.
| 实验 编号 |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| Ⅰ | 298 | 3 | 6.0 | 0.30 |
| Ⅱ | 313 | 3 | 6.0 | 0.30 |
| Ⅲ | 298 | 10 | 6.0 | 0.30 |
在50~150s内的反应速率ν(p-CP)=
②实验Ⅰ、Ⅱ表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:
③实验Ⅲ得出的结论是:pH=10时,
过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是 。
|

(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是: 。
A. BaO 2 + H2SO 4 === BaSO4 ↓ + H2O2
B. 2NH4HSO4![]() (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
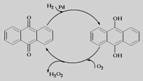
D.乙基蒽醌法:
(3)碱性氢氧燃料电池工作时可产生过氧化氢(见下左图),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如下右图)。
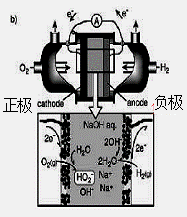
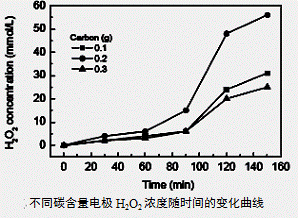
下列说法正确的有 。
A.开始时速率均较慢,说明电极有一个活化的过程
B.一段时间后,速率又再次平缓,说明生成与分解逐渐趋向平衡
C.正极室流出液经酸化后可分离出过氧化氢
D.正极含碳的质量以0.2g适宜
(4)过氧化氢作为一种绿色氧化剂有广泛应用,请写出下列反应的化学方程式:
①在过氧化氢作用下,铜与稀硫酸制硫酸铜: 。
②用Ti-Si分子筛作催化剂,甲苯被过氧化氢氧化为间-甲苯酚: 。
查看习题详情和答案>>通常状况下,过氧化氢是一种无色透明的液体,在实验室和生产中应用广泛.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642.2 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1
H2O(l)=H2O(g) △H=44 kJ·mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l)的热化学方程式:________.
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为________.
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如下图所示,再加热水解即可得H2O2和(NH4)2SO4.

①电解时,阳极的电极方程式________;
②写出生成H2O2的反应的化学方程式:
________.
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如下图所示.
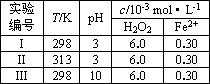
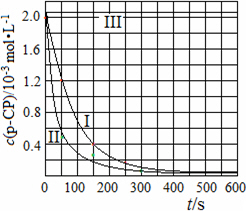
①请根据实验I的曲线,计算降解反应在50~150 s内的反应速率ν(p-CP)=________mol·L-1·s-1.
②实验I、II表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:________.
③实验III得出的结论是:pH=10时,________.
过氧化氢(H2O2)是一种无色透明粘稠状液体,它的水溶液俗称双氧水,呈弱酸性,一种强氧化剂,漂白剂,消毒剂,是生产过氧化物的原料.
(1)写出H2O2的电子式_________________,
(2)H2O2与强碱反应可生成正盐,一定条件下也生成酸式盐,写出NaOH与H2O2反应生成酸式盐的化学方程式:____________________.
(3)在H2O2中加入少量苯,再滴人数滴K2Cr2O7的硫酸溶液,振荡静置,苯层呈蓝色,这是由于反应生成过氧化铬(CrO5)溶于苯的缘故,已知过氧化铬的结构式为:①写出该反应的离子方程式:________________
②这个反应是否是氧化还原反应?________,其理由是________
(4)双氧水属于________(A强电解质、B弱电解质、C非电解质、D以上都错),它被称为“绿色氧化剂”,理由是__________________________________.
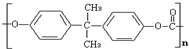 上海世博会于2010年5月1日开幕,本次世博会将以“绿色、低碳、节能、减排”为理念来选取材料设计展馆,上海企业联合馆的外围立面材料采用了聚碳酸酯透明塑料(如图),该材料是一种无色透明的无定性热塑性材料.其名称来源于其内部的CO3基团. 化学名:2,2'-双(4-羟基苯基)丙烷聚碳酸酯.下列关于聚碳酸酯的说法正确的( )
上海世博会于2010年5月1日开幕,本次世博会将以“绿色、低碳、节能、减排”为理念来选取材料设计展馆,上海企业联合馆的外围立面材料采用了聚碳酸酯透明塑料(如图),该材料是一种无色透明的无定性热塑性材料.其名称来源于其内部的CO3基团. 化学名:2,2'-双(4-羟基苯基)丙烷聚碳酸酯.下列关于聚碳酸酯的说法正确的( )| A、其单体是苯的同系物 | B、由单体合成聚碳酸酯属加聚反应 | C、该高分子化合物易溶于水 | D、没有固定的熔沸点 |