摘要:在标准状况下,mgA气体与ngB气体分子数相等.下列说法不正确的是: ( ) A.标准状况下.同体积的气体A和气体B的质量比m∶n B.25℃时.1Kg气体A与1Kg气体B的分子数之比为n∶m C.同温同压下.气体A与气体B的密度之比为n∶m D.标准状况下.等质量的A与B的体积比为m∶n
网址:http://m.1010jiajiao.com/timu3_id_422282[举报]
A和B在一定条件下可合成芳香族化合物E,G在标准状况下是气体,此情况下的密度为1.25g/L.各物质间相互转化关系如下所示:

请回答下列问题:
(1)G中的官能团是
 (用化学式表示),D中的官能团名称是
(用化学式表示),D中的官能团名称是
 .
.
(2)指出反应类型:①
(3)写出化学方程式:A→C
(4)满足下列条件的B的同分异构体有
①遇FeCl3溶液显紫色 ②能发生银镜反应 ③苯环上只有两个取代基.
查看习题详情和答案>>

请回答下列问题:
(1)G中的官能团是


羧基
羧基
,F的结构简式为

(2)指出反应类型:①
酯化反应
酯化反应
,②消去反应
消去反应
,③加聚反应
加聚反应
.(3)写出化学方程式:A→C
2CH3CH2OH+O2
2CH3CHO+H2O
| Cu |
| △ |
2CH3CH2OH+O2
2CH3CHO+H2O
;C与新制的氢氧化铜悬浊液反应:| Cu |
| △ |
CH3CHO+2Cu(OH)2
CH3COOH+Cu2 O↓+2H2O
| △ |
CH3CHO+2Cu(OH)2
CH3COOH+Cu2 O↓+2H2O
.| △ |
(4)满足下列条件的B的同分异构体有
3
3
种.①遇FeCl3溶液显紫色 ②能发生银镜反应 ③苯环上只有两个取代基.
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验.请回答相关问题:

(1)定性分析:如图1可通过观察
(2)定量分析:如图2所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为
(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.
①写出H2O2在二氧化锰作用下发生反应的化学方程式
②实验时放出气体的总体积是
③放出
气体所需时间为
④反应放出
气体所需时间约为
⑤A、B、C、D各点反应速率快慢的顺序为
⑥解释反应速率变化的原因
⑦计算H2O2的初始物质的量浓度
查看习题详情和答案>>

(1)定性分析:如图1可通过观察
产生气泡的快慢
产生气泡的快慢
,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是消除阴离子不同对实验的干扰
消除阴离子不同对实验的干扰
.(2)定量分析:如图2所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为
分液漏斗
分液漏斗
,检查该装置气密性的方法是关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位
关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位
,实验中需要测量的数据是40mL气体所需的时间
40mL气体所需的时间
.(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.
①写出H2O2在二氧化锰作用下发生反应的化学方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
②实验时放出气体的总体积是
60mL
60mL
mL.③放出
| 1 |
| 3 |
1
1
min.④反应放出
| 3 |
| 4 |
2.5~2.6
2.5~2.6
min.⑤A、B、C、D各点反应速率快慢的顺序为
D
D
>C
C
>B
B
>A
A
.⑥解释反应速率变化的原因
随着反应的进行,浓度减小,反应速率减慢
随着反应的进行,浓度减小,反应速率减慢
.⑦计算H2O2的初始物质的量浓度
0.11mol?L-1
0.11mol?L-1
.(请保留两位有效数字)(2008?德阳模拟)有一瓶(约100mL)硫酸和硝酸的混合溶液,取出10.00mL该混合溶液,加入足量的氯化钡溶液,充分反应后过滤,洗涤、烘干,可得4.66g沉淀.将滤液跟2.00mol/L NaOH溶液反应,共用去35.00mL碱液时恰好中和.请回答下列问题:
(1)混合溶液中HNO3的物质的量浓度是c(HNO3)=
(2)另取10.00mL原混酸溶液,加入1.60g铜粉共热,其反应的离子方程式是
查看习题详情和答案>>
(1)混合溶液中HNO3的物质的量浓度是c(HNO3)=
3
3
mol/L.(2)另取10.00mL原混酸溶液,加入1.60g铜粉共热,其反应的离子方程式是
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
,在标准状况下产生气体的体积是373.3
373.3
mL.研究发现某些金属离子如Fe3+、Cu2+等对H2O2的分解也具有催化作用,为了比较MnO2与Fe3+和Cu2+的催化效果,某同学设计了如图甲、乙所示的实验.请回答相关问题:
(1)定性分析:图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.检查乙装置气密性的方法是
(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
①写出H2O2在二氧化锰作用下发生反应的化学方程式
②实验时放出气体的总体积是
③A、B、C、D各点反应速率快慢的顺序为D>C>B>A.解释反应速率变化的原因:
④计算H2O2的初始物质的量浓度为
查看习题详情和答案>>

(1)定性分析:图甲可通过观察
产生气泡的快慢
产生气泡的快慢
,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3或者将CuSO4改为CuCl2更为合理,其理由是消除阴离子不同对实验的干扰
消除阴离子不同对实验的干扰
.(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.检查乙装置气密性的方法是
关闭分液漏斗活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位
关闭分液漏斗活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位
,实验中需要测量的数据是产生40mL气体所需的时间
产生40mL气体所需的时间
.(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
①写出H2O2在二氧化锰作用下发生反应的化学方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
②实验时放出气体的总体积是
60
60
mL.反应放出气体所需时间约为4
4
min.③A、B、C、D各点反应速率快慢的顺序为D>C>B>A.解释反应速率变化的原因:
随着反应的进行,浓度减小,反应速率减慢
随着反应的进行,浓度减小,反应速率减慢
.④计算H2O2的初始物质的量浓度为
0.11mol?L-1
0.11mol?L-1
mol/L.(请保留两位有效数字)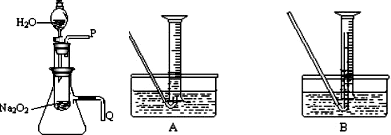 (2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一:有氧气生成;第二:
该反应是放热反应
该反应是放热反应
.Na2O2跟水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.(2)某研究性学习小组拟用右图所示装置(气密性良好)
进行实验,以证明上述结论.
用以验证第一条结论的实验操作是:
打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成
打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成
;用以验证第二条结论的实验方法是:
将导管Q浸入水中,反应过程中导管口有气泡冒出
将导管Q浸入水中,反应过程中导管口有气泡冒出
.(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色.为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性.请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在.(只要求写出实验所用的试剂及观察到的现象)
试剂:
MnO2
MnO2
;现象:气泡迅速产生,能使带火星的木条复燃
气泡迅速产生,能使带火星的木条复燃
.(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论.
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积)
B
B
(填序号),理由是防止气体冷却时发生倒吸现象
防止气体冷却时发生倒吸现象
.②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
500mL
500mL
(选填“100mL”“200mL”“500mL”或“1000mL”).