题目内容
 (2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一:有氧气生成;第二:
该反应是放热反应
该反应是放热反应
.Na2O2跟水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
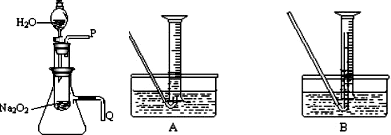
.(2)某研究性学习小组拟用右图所示装置(气密性良好)
进行实验,以证明上述结论.
用以验证第一条结论的实验操作是:
打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成
打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成
;用以验证第二条结论的实验方法是:
将导管Q浸入水中,反应过程中导管口有气泡冒出
将导管Q浸入水中,反应过程中导管口有气泡冒出
.(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色.为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性.请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在.(只要求写出实验所用的试剂及观察到的现象)
试剂:
MnO2
MnO2
;现象:气泡迅速产生,能使带火星的木条复燃
气泡迅速产生,能使带火星的木条复燃
.(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论.
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积)
B
B
(填序号),理由是防止气体冷却时发生倒吸现象
防止气体冷却时发生倒吸现象
.②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
500mL
500mL
(选填“100mL”“200mL”“500mL”或“1000mL”).分析:(1)脱脂棉燃烧除了有氧气外,必须要达到其燃点,据此可判断该反应是放热反应;
(2)该小题实质上是考查氧气的检验、气密性检查等化学实验基本操作方法的运用,将带火星的木条靠进导管口p处,木条复燃,将导管q浸入水中,反应过程中导管口有气泡冒出;
(3)H2O2在MnO2催化条件下会生成氧气;
(4)测量气体体积时,为防止倒吸应将导管尽量插入量筒底部,使用的量筒应是生成氧气的最大值.
(2)该小题实质上是考查氧气的检验、气密性检查等化学实验基本操作方法的运用,将带火星的木条靠进导管口p处,木条复燃,将导管q浸入水中,反应过程中导管口有气泡冒出;
(3)H2O2在MnO2催化条件下会生成氧气;
(4)测量气体体积时,为防止倒吸应将导管尽量插入量筒底部,使用的量筒应是生成氧气的最大值.
解答:解:(1)脱脂棉燃烧除了有氧气外,必须要达到其燃点,则该反应为放热反应,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:该反应是放热反应; 2Na2O2+2H2O=4NaOH+O2↑;
(2)检验是否有氧气生成,可根据氧气能使带火星的木条复燃进行检验,具体做法是打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成;该反应为放热反应,容器温度升高,容器内气体会膨胀,因此,将导管q浸入水中,反应过程中导管口有气泡冒出;
故答案为:打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成;将导管Q浸入水中,反应过程中导管口有气泡冒出;
(3)H2O2在MnO2催化条件下会生成氧气,加入催化剂,过氧化氢分解生成氧气,溶液中有气泡产生,且能使带火星的木条复燃,证明有氧气生成,故答案为:MnO2; 气泡迅速产生,能使带火星的木条复燃;
(4)①测量气体体积时,为防止倒吸应将导管尽量插入量筒底部,所以应用B装置,
故答案为:B;防止气体冷却时发生倒吸现象;
②n(Na2O2)=
=
mol,
2Na2O2+2H2O=4NaOH+O2↑
2mol 22.4L
mol V(O2)
V(O2)=
=0.373L=373mL,
所以应用500mL的量筒,
故答案为:500mL.
故答案为:该反应是放热反应; 2Na2O2+2H2O=4NaOH+O2↑;
(2)检验是否有氧气生成,可根据氧气能使带火星的木条复燃进行检验,具体做法是打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成;该反应为放热反应,容器温度升高,容器内气体会膨胀,因此,将导管q浸入水中,反应过程中导管口有气泡冒出;
故答案为:打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成;将导管Q浸入水中,反应过程中导管口有气泡冒出;
(3)H2O2在MnO2催化条件下会生成氧气,加入催化剂,过氧化氢分解生成氧气,溶液中有气泡产生,且能使带火星的木条复燃,证明有氧气生成,故答案为:MnO2; 气泡迅速产生,能使带火星的木条复燃;
(4)①测量气体体积时,为防止倒吸应将导管尽量插入量筒底部,所以应用B装置,
故答案为:B;防止气体冷却时发生倒吸现象;
②n(Na2O2)=
| 2.6g |
| 78g/mol |
| 1 |
| 30 |
2Na2O2+2H2O=4NaOH+O2↑
2mol 22.4L
| 1 |
| 30 |
V(O2)=
| ||
| 2mol |
所以应用500mL的量筒,
故答案为:500mL.
点评:本题重视从高中化学课本实验中选取命题素材,重视在课本实验的基础上考查探究能力是化学学科最有吸引力的话题之一.实验题,倾向于考查化学实验基本操作,倾向于把一些课本小实验重组成一个微型的研究课题,所以要提高解答化学实验题的得分率必须从课本中的基本实验入手.

练习册系列答案
相关题目
