网址:http://m.1010jiajiao.com/timu3_id_422061[举报]
(15 分)
A、B、C、D均是前四周期元素组成的单质或化合物。它们之间有如下转化关系:
![]()
(1) 若A是某矿石的主要成份,上述转化关系表示工业生产D的过程,且反应②在接触室中进行,反应①在______(填设备名称)中进行。工业上使用______吸收C,以提高吸收效率。
(2) 若D是能使澄清石灰水变浑浊的无色无味气体,A、B为两种单质,组成它们的元素原子序数之和为18,②、③均为化合反应,则反应①中氧化剂与还原剂的质量之比为______
(3) 若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是______检验C中金属阳离子的常见试剂是______(填名称)。
(4) 若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______ (填字母)。
a. A可能是一种耐火材料;
b. B的溶液一定呈碱性;
c. C 一定既溶于盐酸又溶于苛性钠溶液;
则B与D在溶液中反应的离子方程式为________________________。
查看习题详情和答案>>现有A、B、C、D、E五种物质,它们有如下反应关系:
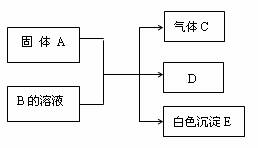
(1)若A是由短周期中原子半径最大的元素与地壳中含量最多的元素组成的离子化合物,且两种元素的原子个数比为1:1。则A中存在的化学键是 、 。
(2)若A是可溶性强碱,B是正盐,E不溶于稀硝酸,则B的化学式为 ,
(3)若A是NaHCO3,B是正盐,E既可溶于盐酸又可溶于NaOH溶液,该反应的离子方程式为 。
(4)若C是一种四原子分子,燃烧时有浓烈的黑烟。A与B的溶液反应时只生成气体C、CaCO3和H2O。
①C的电子式为 ;
B的名称为 。
②若在标准状况下,用下图的装置进行实验,欲测定某电石试样中 A 的质量分数,请回答下列问题:
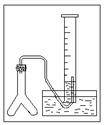
若反应刚结束时,观察到的实验现象如图所示,这时不能立即读数,应待 以后再进行的操作是: ,之后读出气体的体积是d L,如果电石试样质量为 c g,则电石试样中 A 的质量分数的计算式W ( A )= (杂质所生成的气体体积忽略不计)。
查看习题详情和答案>>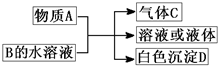 (2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
(2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.(1)若A是碳化钙,A与B的水溶液反应时只生成气体C、CaCO3和H2O.则B(只含两种元素)的化学式为
(2)若A是短周期中原子半径最大的元素的单质,D既可溶于NaOH溶液又可溶于盐酸.请写出:
①D溶于盐酸的离子方程式
②工业上冶炼A的化学方程式
| ||
| ||
③实验室用惰性电极电解100mL 0.1mol/L A的氯化物的水溶液(滴有酚酞),一段时间后,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为
(3)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则反应的化学方程式是
(4)若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式是
(1)若A是碳化钙,A与B的水溶液反应时只生成气体C、CaCO3和H2O.则B(只含两种元素)的化学式为______,其固态时的晶体为______晶体;C分子中含有的化学键类型是______.
(2)若A是短周期中原子半径最大的元素的单质,D既可溶于NaOH溶液又可溶于盐酸.请写出:
①D溶于盐酸的离子方程式______.
②工业上冶炼A的化学方程式______.
③实验室用惰性电极电解100mL 0.1mol/L A的氯化物的水溶液(滴有酚酞),一段时间后,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为______(忽略反应前后溶液的体积变化).某电极附近溶液颜色变红,原因是______,则该电极与外接直流电源的______极相连接(填“正”、或“负”).
(3)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则反应的化学方程式是______.
(4)若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式是______.
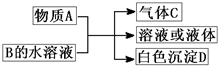
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
①用pH试纸检验A、B两溶液呈碱性;而C、D、E三溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(注:沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C溶液只能与D溶液反应产生沉淀.
请回答下列问题:
(1)写出A溶液呈碱性的原因(用离子方程式表示):______.
(2)向含1molE的溶液中逐滴加入B,以n(B)为横坐标以n(沉淀)为纵坐标.请在图中画出相应的图象:
(3)写出C溶液与D溶液反应的离子方程式:______.
Ⅱ.已知短周期元素X、Y、Z的原子序数依次递增,X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族.请回答下列问题:
(1)能证明Y2ZX3溶液显碱性,且在溶液中存在水解平衡的事实是______(填序号).
a.滴入酚酞溶液变红,再加入稀H2SO4红色褪去
b.滴入酚酞溶液变红,再加入氯水红色褪去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色褪去
(2)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):
Cu2Z
| 浓硝酸 |
| 一定量NaOH |
| D的溶液 |
已知Cu2X与浓硝酸反应有红棕色气体生成,则该反应的化学反应方程式是:______.
(3)某温度下,在一个5L的密闭容器中充入0.2molZX2和0.1molX2,20s后达到平衡,测得容器中含有0.18molZX3,则用X2的浓度变化来表示该反应的平均速率是:v(X2)=______;此温度下该反应的化学平衡常数K=______(要求带单位).