摘要:20.W.X.Y.Z是原子序数依次增大的同一周期元素.原子序数均小于18.W.X是金属元素.Y.Z是非金属元素. (1)已知:W.X各自的氧化物对应的水化物可以反应生成盐和水.写出X的氧化物与过量氢氧化钠溶液反应的离子方程式 . (2)W与Y可形成化合物W2Y.该化合物水溶液呈碱性.用离子方程式解释其原因: . (3)Y的某氧化物通入Z单质的水溶液中.发生反应生成两种强酸的化学方程式为: . (4)写出Z-离子的核外电子排布式: . (5)W.X.Y.Z四种元素简单离子的半径由小到大的顺序是 < < < . 21.工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法.沉淀转化法等.高温煅烧还原法的工艺流程可简单的表示如下: 已知:BaSO4+4CO(g) △H=+571.2 kJ•mol-1 Ba+2O2(g):BaSO4(s) △H=-1473.2 kJ•mol-1 Ba △H=-460 kJ•mol-1 请回答: (1)工业上煅烧重晶石矿粉时.为使BaSO4得到充分还原和维持反应所需的高温.应采取的措施是 . (2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3: BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq) 则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为 (3)与高温煅烧还原法相比.用饱和Na2CO3溶液沉淀转化法的优点主要有
网址:http://m.1010jiajiao.com/timu3_id_419916[举报]
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为
(2)W与Y 可形成化合物W2Y,该化合物的电子式为
 .
.
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
(4)比较Y、Z气态氢化物的稳定性
(5)Y、Z四种元素简单离子的离子半径由大到小的顺序是>>>.
查看习题详情和答案>>
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(2)W与Y 可形成化合物W2Y,该化合物的电子式为


(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
SO2+Cl2+2H2O=H2SO4+2HCl
SO2+Cl2+2H2O=H2SO4+2HCl
.(4)比较Y、Z气态氢化物的稳定性
HCl
HCl
>H2S
H2S
(用分子式表示).(5)Y、Z四种元素简单离子的离子半径由大到小的顺序是>>>.
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为
(2)W与Y可形成化合物W2Y,该化合物的电子式为
 .
.
(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):
(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式
查看习题详情和答案>>
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O;
Al(OH)3+OH-=AlO2-+2H2O;
.(2)W与Y可形成化合物W2Y,该化合物的电子式为


(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):
S2-
S2-
>Cl-
Cl-
>Na+
Na+
>Al3+
Al3+
.(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式
Cl2O7+H2O=2H++2ClO4-
Cl2O7+H2O=2H++2ClO4-
.W、X、Y、Z是原子序数依次增大的短周期元素.W的最外层电子数是电子层数的2倍.Y是金属,可以和X形成1:1和2:1两种化合物.Z的最高正价与最低负价的代数和为4.
(1)写出WX2的电子式
 .
.
(2)用元素符号表示X、Y、Z原子半径由大到小的顺序
(3)含1molZ的最高价氧化物对应水化物的稀溶液与足量Y的最高价氧化物对应水化物的稀溶液反应放出热量114.6kJ,写出此反应的热化学方程式:
(4)100ml1mol/LY的最高价氧化物对应水化物的稀溶液中通入标准状况下1.12LWX2,反应后溶液呈
(5)Y2ZX4与WX、H2在高温和铁做催化剂条件下反应,0.1mol Y2ZX4参加反应转移0.8mol电子,消耗标况下H2的体积为4.48L,该反应的化学方程式为
查看习题详情和答案>>
(1)写出WX2的电子式


(2)用元素符号表示X、Y、Z原子半径由大到小的顺序
Na>S>O
Na>S>O
.(3)含1molZ的最高价氧化物对应水化物的稀溶液与足量Y的最高价氧化物对应水化物的稀溶液反应放出热量114.6kJ,写出此反应的热化学方程式:
2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol
2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol
.(4)100ml1mol/LY的最高价氧化物对应水化物的稀溶液中通入标准状况下1.12LWX2,反应后溶液呈
碱
碱
性,原因是(用离子方程式解释):CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
. (5)Y2ZX4与WX、H2在高温和铁做催化剂条件下反应,0.1mol Y2ZX4参加反应转移0.8mol电子,消耗标况下H2的体积为4.48L,该反应的化学方程式为
Na2SO4+2CO+2H2
Na2S+2CO2+2H2O
| ||
| △ |
Na2SO4+2CO+2H2
Na2S+2CO2+2H2O
.
| ||
| △ |
W、X、Y、Z是原子序数依次增大的短周期元素.W的最外层电子数是电子层数的2倍.Y是金属,可以和X形成原子个数比1:1和2:1两种化合物.Z的最高正价与最低负价的代数和为4.
(1)写出WX2的电子式
 .
.
(2)用元素符号表示X、Y、Z原子半径由大到小的顺序
(3)在一定量Y的最高价氧化物对应水化物的稀溶液中通入过量WX2,该反应的离子方程式为
(4)Y2ZX4与WX、H2在高温和铁做催化剂条件下反应,0.1mol Y2ZX4参加反应转移0.8mol电子,消耗标况下H2的体积为4.48L,该反应的化学方程式为
查看习题详情和答案>>
(1)写出WX2的电子式


(2)用元素符号表示X、Y、Z原子半径由大到小的顺序
Na
Na
>S
S
>O
O
.(3)在一定量Y的最高价氧化物对应水化物的稀溶液中通入过量WX2,该反应的离子方程式为
OH-+CO2=HCO3-;
OH-+CO2=HCO3-;
;用离子浓度表示该溶液中的电荷守恒c(HCO3-)+2c(CO32-)+c(OH-)=c(Na+)+c(H+)
c(HCO3-)+2c(CO32-)+c(OH-)=c(Na+)+c(H+)
.(4)Y2ZX4与WX、H2在高温和铁做催化剂条件下反应,0.1mol Y2ZX4参加反应转移0.8mol电子,消耗标况下H2的体积为4.48L,该反应的化学方程式为
Na2SO4+2CO+2H2
Na2S+2CO2+2H2O
| ||
| △ |
Na2SO4+2CO+2H2
Na2S+2CO2+2H2O
.
| ||
| △ |
 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:(1)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,试写出C的结构简式为:
CH3COOCH2CH3
CH3COOCH2CH3
.(2)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式:
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
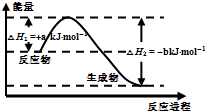
(3)XW4是一种重要能源物质,如图是1.01×105Pa下,1mol XW4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1
;(4)向50mL 4mol?L-1的NaOH溶液中通入4.48L元素X的最高价氧化物(标准状况),反应后溶液呈
碱性
碱性
,填(“中性”、“酸性”、或“碱性”),理由是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W4Y2Z3,则该溶液中离子浓度由大到小的顺序为:
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.