题目内容
 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:(1)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,试写出C的结构简式为:
CH3COOCH2CH3
CH3COOCH2CH3
.(2)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式:
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
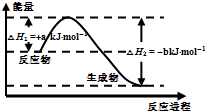
(3)XW4是一种重要能源物质,如图是1.01×105Pa下,1mol XW4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1
;(4)向50mL 4mol?L-1的NaOH溶液中通入4.48L元素X的最高价氧化物(标准状况),反应后溶液呈
碱性
碱性
,填(“中性”、“酸性”、或“碱性”),理由是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W4Y2Z3,则该溶液中离子浓度由大到小的顺序为:
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.分析:氕原子的原子核中没有中子,故W是H,元素Z在地壳中含量最高,所以Z是O,Y与X相邻,Y与Z也相邻,X、Y、Z三种元素原子的最外层电子数之和为3的整数倍,则X为C,Y为N.
(1)乙酸和乙醇可以发生酯化反应生成乙酸乙酯;
(2)碳单质可以和浓硝酸反应生成二氧化氮、二氧化碳以及水;
(3)反应物和生成物具有的能量差即为化学反应的热效应数值,当反应物能量高于生成物的能量时,反应是放热反应;
(4)氢氧化钠可以和过量的二氧化碳反应生成碳酸氢钠,碳酸氢钠水溶液显碱性;
(5)硝酸铵是强酸弱碱盐,铵根离子水解显示酸性.
(1)乙酸和乙醇可以发生酯化反应生成乙酸乙酯;
(2)碳单质可以和浓硝酸反应生成二氧化氮、二氧化碳以及水;
(3)反应物和生成物具有的能量差即为化学反应的热效应数值,当反应物能量高于生成物的能量时,反应是放热反应;
(4)氢氧化钠可以和过量的二氧化碳反应生成碳酸氢钠,碳酸氢钠水溶液显碱性;
(5)硝酸铵是强酸弱碱盐,铵根离子水解显示酸性.
解答:解:氕原子的原子核中没有中子,故W是H,元素Z在地壳中含量最高,所以Z是O,Y与X相邻,Y与Z也相邻,X、Y、Z三种元素原子的最外层电子数之和为3的整数倍,则X为C,Y为N.
(1)由H、C、O三种元素可组成的三种常见的有机化合物中,乙酸和乙醇是日常生活中常用调味品的主要成分,二者反应生成乙酸乙酯,故答案为:CH3COOCH2CH3;
(2)碳单质可以和H、N、O组成的化合物浓硝酸反应生成二氧化氮、二氧化碳以及水,即C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
(3)根据甲烷燃烧的过程可以看出是一个放热反应过程,放出的热量即为(b-a)kJ,故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1;
(4)向50mL 4mol?L-1(即0.2mol)的NaOH溶液中通入4.48Lji 0.2mol元素C的最高价氧化物(标准状况)二氧化碳后,发生反应生成碳酸氢钠,由于碳酸氢根水解导致溶液显示碱性,故答案为:碱性;HCO3-+H2O?H2CO3+OH-;
(5)H、N、O三种元素可组成一种无机盐,其组成可表示为H4N2O3,即硝酸铵中,铵根离子水解,溶液显示酸性,即c(NO3-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(1)由H、C、O三种元素可组成的三种常见的有机化合物中,乙酸和乙醇是日常生活中常用调味品的主要成分,二者反应生成乙酸乙酯,故答案为:CH3COOCH2CH3;
(2)碳单质可以和H、N、O组成的化合物浓硝酸反应生成二氧化氮、二氧化碳以及水,即C+4HNO3(浓)
| ||
| ||
(3)根据甲烷燃烧的过程可以看出是一个放热反应过程,放出的热量即为(b-a)kJ,故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1;
(4)向50mL 4mol?L-1(即0.2mol)的NaOH溶液中通入4.48Lji 0.2mol元素C的最高价氧化物(标准状况)二氧化碳后,发生反应生成碳酸氢钠,由于碳酸氢根水解导致溶液显示碱性,故答案为:碱性;HCO3-+H2O?H2CO3+OH-;
(5)H、N、O三种元素可组成一种无机盐,其组成可表示为H4N2O3,即硝酸铵中,铵根离子水解,溶液显示酸性,即c(NO3-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-).
点评:本题是一道原子结构和热化学、盐的水解知识结合的综合考查题目,考查学生分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
 Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.