摘要:20.1922年的诺贝尔化学奖为提出应用质子核磁共振谱(PMR)研究有机物结构的科学家所获得.1991年和2002年两年的诺贝尔化学奖即为应用此项技术在有机物结构研究领域有重大发现的几位科学家获得.有机分子中.不同氢原子在PMR中对应不同的峰.且峰的强度与分子中同类氢原子个数成正比.例如丙烷分子有两种不同的H(甲基中的H和亚甲基中的H).PMR有两个峰.且两个峰的强度比为6∶2(或写成3∶1.前者为甲基上氢对应的峰.后者为亚甲基上氢对应的峰),同理.甲醇分子的PMR有两个峰.且强度比为3∶1. ⑴ 乙烷分子的PMR有 个峰, 分子的PMR有 个峰. ⑵ 在运用PMR谱确定C2H6O结构时.在核磁共振谱上给出的峰有两组.其中一组只有一个信号峰.该组信号峰对应物质的结构简式为 .另一组有三个信号峰.则三个信号峰的强度比为 . ⑶ 化学式为C6H14的物质有多种.其中有一种在核磁共振谱上的信号峰有5个.该物质的结构简式为 .另有一种在核磁共振谱上的信号峰只有2个.该物质名称为 .
网址:http://m.1010jiajiao.com/timu3_id_41990[举报]
2009年三位科学家万卡特拉曼?莱马克里斯南、托马斯?施泰茨和阿达?尤纳斯因为“核糖体的结构和功能”的研究而获得该年的诺贝尔化学奖.核糖体含有的元素除氮、磷等元素外,一定含有的元素是( )
查看习题详情和答案>>
(1)1799年,意大利物理学家伏特制成了世界上第一个电池-“伏打”电池,直接促进了人类文明的发展.下列①~⑤装置中,能构成原电池的是

(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
工业合成氨的反应是
查看习题详情和答案>>
①
①
(填序号),其正极反应式为2H++2e-=H2↑
2H++2e-=H2↑
,负极反应式为Zn-2e-=Zn 2+
Zn-2e-=Zn 2+
,电子向正极
正极
(填“正极”或“负极”,下同)运动,H+向正极
正极
运动.
(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
N2(g)+3H2(g)
2NH3(g)
| ||
| 高温高压 |
N2(g)+3H2(g)
2NH3(g)
.
| ||
| 高温高压 |
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
| 化学键 | H-H | N≡N | H-N |
| 生成(或断裂)1mol化学键时放出(或吸收)的能量 | 436kJ | 946kJ | 390kJ |
放热
放热
(填“放热”或“吸热”)反应,1molN2完全反应时对应热量的数值为92
92
kJ.1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献.Grignard试剂的合成方法是:RX+Mg
RMgX(Grignard试剂).生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:?
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性.合成线路如下:
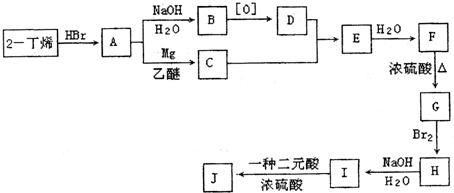 ?
?
请按要求填空:
(1)3,4-二甲基-3-己醇是:
 ;
;
(2)H→I的反应类型是
(3)写出下列化学反应方程式(有机物请用结构简式表示):?
A→B
 ;
;
I→J
 .
.
查看习题详情和答案>>
| 乙醇 |

现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性.合成线路如下:
 ?
?请按要求填空:
(1)3,4-二甲基-3-己醇是:
F
F
(填字母代号),G的结构简式是

(2)H→I的反应类型是
取代反应
取代反应
,F→G的反应类型是消去反应
消去反应
;(3)写出下列化学反应方程式(有机物请用结构简式表示):?
A→B


I→J


2004年的诺贝尔化学奖授予以色列科学家阿龙?切哈诺夫、阿夫拉姆?赫什科和美国科学家欧文?罗斯,以表彰他们发现了泛素调节蛋白质水解.关于蛋白质的组成与性质的叙述正确的是( )
| A、蛋白质在酶的作用下水解的最终产物为氨基酸 | B、向蛋白质溶液中加入(NH4)2SO4浓溶液,会使其变性 | C、天然蛋白质仅由碳、氢、氧、氮四种元素组成 | D、氨基酸和蛋白质都是只能和碱反应的酸性物质 |
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图
 .
.
(2)由以上元素形成的金属单质中,熔点最低的是
(3)NH3?H2O的电离方程式为NH3?H2O NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(5)利用稀有气体化合物,人们实现了许多制备实验上的突破.如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式:
(6)a与g形成的化合物是
查看习题详情和答案>>
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | ||||||||||||||
| i | |||||||||||||||||
| j | |||||||||||||||||


(2)由以上元素形成的金属单质中,熔点最低的是
Na
Na
.(填元素符号)(3)NH3?H2O的电离方程式为NH3?H2O
 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是(b)
(b)
(填序号). (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是j
j
(填写字母).(5)利用稀有气体化合物,人们实现了许多制备实验上的突破.如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式:
XeO3+3NaBrO3═3NaBrO4+Xe↑
XeO3+3NaBrO3═3NaBrO4+Xe↑
.(6)a与g形成的化合物是
共价
共价
(填“离子”或“共价”)化合物.