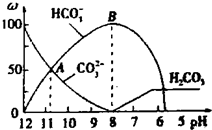
摘要:常温下.在20mL.0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L盐酸40mL.测得溶液中含碳元素的部分微粒其物质的量浓度的百分含量随PH变化的曲线如图所示.试回答: (1)在0.1mol/LNa2CO3溶液中c(Na+)/c(CO32-) 2(填“> .“< 或“= )其溶液中所有阳离子和阴离子的浓度满足的等式关系为: . (2)当加入盐酸使溶液PH为10时.混合液中含碳元素的离子有哪些? .其物质的量之比为: . (3)该实验过程中.随着盐酸的加入.HCO3-的浓度变化趋势为 ,写出OAB段发生的离子反应方程式: .及BC段所发生的离子反应方程式: . (4)当混合液PH= 时.才开始放出CO2气体.
网址:http://m.1010jiajiao.com/timu3_id_419025[举报]
 常温下,在10mL 0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1HCl溶液20mL,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(ω)变化如图所示(CO2因逸出未画出),下列说法正确的是( )
常温下,在10mL 0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1HCl溶液20mL,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(ω)变化如图所示(CO2因逸出未画出),下列说法正确的是( )常温下在20mL 0.1mol.L-1 Na2CO3溶液中逐渐加入0.1mol.L-1的HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的物质的量的百分量(纵轴)也发生变化(CO2会逸出未画出),如图所示,回答下列问题:
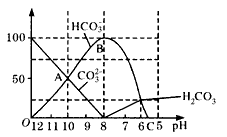
(1)随着盐酸的加入,HCO3-的浓度变化趋势是____;请写出 OAB段的离子方程式:____。
(2)当加入盐酸使溶液的pH=10时,混合溶液中含碳元素的离子有 ____,其物质的量之比是____;当pH=7时,混合溶液中含碳元素的微粒有____。
(3)在pH=____时开始逸出CO2气体,当pH=5时,逸出的气体的物质的量____0. 002mol(填“>”、“<”或“=”)。
查看习题详情和答案>>
(2)当加入盐酸使溶液的pH=10时,混合溶液中含碳元素的离子有 ____,其物质的量之比是____;当pH=7时,混合溶液中含碳元素的微粒有____。
(3)在pH=____时开始逸出CO2气体,当pH=5时,逸出的气体的物质的量____0. 002mol(填“>”、“<”或“=”)。