摘要:28.W.X.Y.Z四种短周期元素在元素周期表中的位置如右图所示.其中Y与钠元素和氢元素均可形成原子个数l:1和1:2的化合物. 请回答下列问题. (1)W元素形成的同素异形体的晶体类型可能是 . ①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体 (2)H2Y2的电子式为 .Na2Y2中的化学键种类为: . (3)在右图中.b的pH约为7.且含有Fe2+和淀粉KI的水溶液.a为H2Y2的水溶液.旋开分液漏斗旋钮.观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成.当消耗2 molI-时.共转移3mol电子.该反应的离子方程式是 . (4)已知:298K时.金属钠与Y2气体反应.若生成1 molNa2Y固体时.放出热量414 kJ,若生成1mol Na2Y2固体时.放出热量511 kJ.则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为 . (5)X的原子结构示意图为 .Z在周期表中的位置 . (6)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料.同时获取电能.假设这种想法可行.用石墨作电极材料.用稀盐酸作电解质溶液.则通入Z2的电极为原电池的 极.其电极反应式为 .
网址:http://m.1010jiajiao.com/timu3_id_418221[举报]
 W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族.请回答下列问题.
W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族.请回答下列问题.(1)W的原子结构示意图为


酸性强弱为HClO4>H3PO4
酸性强弱为HClO4>H3PO4
(举一例).(2)W、Y和氢3种元素所形成的一种化合物,其75%(体积分数)的溶液常用于医疗消毒,该化合物的结构简式为
CH3CH2OH
CH3CH2OH
.(3)电解NaZ水溶液时,阴极的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
.工业上,以上述反应的阳极产物和Ca(OH)2为原料,制备漂白粉反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.(4)已知:298K时,金属钠与Y2气体反应,生成1mol Na2Y固体时,放出热量414kJ;生成1mol Na2Y2固体时,放出热量511kJ.由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为
Na2O(s)+
O2(g)=Na2O2(s);△H=-97kJ/mol
| 1 |
| 2 |
Na2O(s)+
O2(g)=Na2O2(s);△H=-97kJ/mol
.| 1 |
| 2 |
W、X、Y、Z四种短周期元素在元素周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数l:1和1:2的化合物.
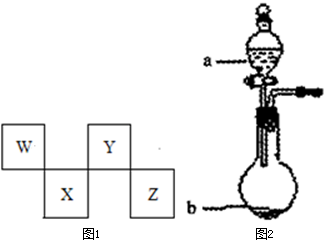
请回答下列问题.
(1)W元素形成的同素异形体的晶体类型可能是(填序号) .
①原子晶体 ②离子晶体③分子晶体 ④金属晶体
(2)H2Y2的电子式为 ,Na2Y2中的化学键种类为: .
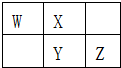
(3)在图2中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成.当消耗2molI-时,共转移3mol电子,该反应的离子方程式是 .
(4)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1mol Na2Y2固体时,放出热量511kJ.则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为 .
(5)X的原子结构示意图为 .Z在周期表中的位置 .
(6)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能.假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z2的电极为原电池的 极,其电极反应式为 .
查看习题详情和答案>>

请回答下列问题.
(1)W元素形成的同素异形体的晶体类型可能是(填序号)
①原子晶体 ②离子晶体③分子晶体 ④金属晶体
(2)H2Y2的电子式为
(3)在图2中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成.当消耗2molI-时,共转移3mol电子,该反应的离子方程式是
(4)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1mol Na2Y2固体时,放出热量511kJ.则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为
(5)X的原子结构示意图为
(6)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能.假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z2的电极为原电池的
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A、X、Y、Z中最简单氢化物稳定性最弱的是Y | B、Z元素氧化物对应水化物的酸性一定强于Y | C、X元素形成的单核阴离子还原性大于Y | D、Z元素单质在化学反应中只表现氧化性 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列结论正确的是( )
| W | X | |
| Y | Z |
| A、X、Y、Z中最简单氢化物稳定性最弱的是Z |
| B、Z元素氧化物对应水化物的酸性一定强于Y |
| C、Z元素单质在化学反应中只表现氧化性 |
| D、X、Y、Z元素形成的单核阴离子还原性最强的是Y |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,下列判断不正确的是( )
| W | X | |
| Y | Z |
| A、原子半径大小:W>X |
| B、元素最高正价:W>Z |
| C、简单阴离子的还原性:Y>Z |
| D、气态氢化物的稳定性:X>Y |