网址:http://m.1010jiajiao.com/timu3_id_417742[举报]
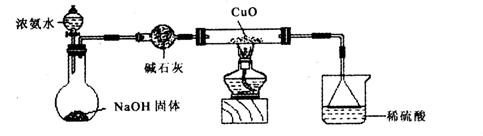
(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是___________,稀硫酸的作用是____________________________________。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
③证明NH3具有还原性的实验现象是_______________________________________________。
(2)用吸收了足量尾气的溶掖制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O====(NH4)2Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe2+将转化为沉淀。
①吸收了a mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,请简述实验方法。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是__________________。
查看习题详情和答案>> 某学生课外活动小组利用右图所示装置分别做如下实验:
某学生课外活动小组利用右图所示装置分别做如下实验:(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
利用如图所示的装置和其他必要的仪器用品,完成下列实验。

(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是 ,稀硫酸的作用是 。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③证明NH3具有还原性的实验现象是 。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了![]() mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是 。
查看习题详情和答案>>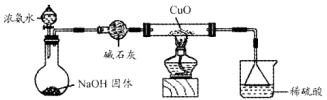
(1)证明氨气具有还原性。已知2NH3+3CuO
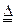 N2+3Cu+3H2O。
N2+3Cu+3H2O。①碱石灰的作用是 ,稀硫酸的作用是 。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③证明NH3具有还原性的实验现象是 。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了
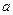 mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。 。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是 。
 I向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象:
I向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象:(1)罐壁内凹而瘪的原因:
反应方程式:
(2)罐壁重新鼓起的原因:
反应方程式:
II某学生课外活动小组利用如图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是