摘要:D 2.B.3.D 4.C 5.A 6.B 7.D.8.D.9.A 10.D
网址:http://m.1010jiajiao.com/timu3_id_416520[举报]
 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:(1)写出由A、B两元素形成的原子个数比为1:1的化合物的化学式
H2O2
H2O2
,此化合物能使酸性KMnO4溶液退色,体现该化合物具有还原性
还原性
性.(2)D元素在元素周期表中的位置
第三周期第ⅥA族
第三周期第ⅥA族
,B和C两元素形成的原子个数比为1:1的化合物中含有的化学键的类型为离子键、共价键
离子键、共价键
.(3)A、B、C、D四种原子半径由大到小为
Na>S>O>H
Na>S>O>H
(填元素符号);四种离子半径由大到小为S2->O2->Na+>H+
S2->O2->Na+>H+
(填离子符号).(4)写出由A、B两元素形成的原子个数比为2:1的化合物与B、C两元素形成的原子个数比为1:1的化合物反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.(5)两种物质均由A、B、C、D四种元素组成,写出它们在水溶液中反应的离子方程式
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
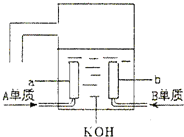
.(6)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用.其构造如图所示.两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.则a是
负
负
极,电极反应式为4H2-4e-=4H+
4H2-4e-=4H+
,b是正
正
极,电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D的核外电子排布图
 ,这样排布遵循了
,这样排布遵循了
查看习题详情和答案>>
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
Si
Si
BNa
Na
CP
P
DN
N
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
HNO3
HNO3
,碱性最强的是NaOH
NaOH
.(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
F
F
,电负性最大的元素是F
F
.(4)D的氢化物比C的氢化物的沸点
高
高
(填“高“或“低“),原因氨气分子之间含有氢键
氨气分子之间含有氢键
(5)E元素原子的核电荷数是
26
26
,E元素在周期表的第四
四
周期,第Ⅷ
Ⅷ
族,已知元素周期表可按电子排布分为s区、p区等,则E元素在d
d
区.(6)A、B、C最高价氧化物的晶体类型是分别是
原子
原子
晶体、离子
离子
晶体、分子
分子
晶体(7)画出D的核外电子排布图


泡利
泡利
原理和洪特
洪特
规则.A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.
(1)在标准状况下为液体的卤素单质是
(2)A的相对分子质量为
(3)写出B与水反应的化学方程式
(4)卤素单质B、C、D的氧化性由大到小的顺序为
查看习题详情和答案>>
| 卤素单质 | 密度(标准状况下) | 沸点/℃ | 熔点/℃ | 溶解度(标准状况下,100g水中) |
| A | 1.696 g?l-1 | -188.1 | -219.6 | -- |
| B | 3.214 g?l-1 | -34.6 | -101 | 226 cm3 |
| C | 3.119 g?cm-3 | 58.78 | -7.2 | 4.16 g |
| D | 4.93 g?cm-3 | 184.4 | 113.5 | 0.029 g |
C
C
(填字母,下同),为固体的卤素单质是D
D
.(2)A的相对分子质量为
38
38
(保留整数)(3)写出B与水反应的化学方程式
Cl2+H2O═HCl+HClO
Cl2+H2O═HCl+HClO
(4)卤素单质B、C、D的氧化性由大到小的顺序为
Cl2>Br2>I2
Cl2>Br2>I2
(用化学式表示)A、B、C、D、E、F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
请回答下列问题:
(1)写出A与E形成的化合物的电子式
 .
.
(2)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是
(3)F的盐酸盐水溶液呈酸性,原因是
(4)化合物M是一种元素C的+6含氧酸钾盐,常用作净水剂与消毒剂.由元素C稳定的氢氧化物与次氯酸钾、氢氧化钾溶液反应制取化合物M,则制备M的离子反应方程式是
查看习题详情和答案>>
| 元素 | 原子结构或性质 | ||
| A | 原子最外层电子数是内层电子总数的
| ||
| B | 形成化合物种类最多的元素,其单质为固体 | ||
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 | ||
| D | 地壳中含量最多的元素 | ||
| E | 与D同主族 | ||
| F | 与E同周期,且最外层电子数等于电子层数 |
(1)写出A与E形成的化合物的电子式


(2)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是
C+H2O
CO+H2
| ||
C+H2O
CO+H2
| ||
(3)F的盐酸盐水溶液呈酸性,原因是
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3
2Fe+Al2O3
| ||
2Al+Fe2O3
2Fe+Al2O3
| ||
(4)化合物M是一种元素C的+6含氧酸钾盐,常用作净水剂与消毒剂.由元素C稳定的氢氧化物与次氯酸钾、氢氧化钾溶液反应制取化合物M,则制备M的离子反应方程式是
2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
.