网址:http://m.1010jiajiao.com/timu3_id_41616[举报]
已知pH=3的酸溶液和pH=11的碱溶液等体积混合后的溶液呈酸性,则发生的反应是
- A.强碱和弱酸溶液之间的反应
- B.强碱和强酸溶液之间的反应
- C.较浓酸溶液和较稀碱溶液之间的反应
- D.多元强酸和一元强碱之间的反应
|
已知pH=3的酸溶液和pH=11的碱溶液等体积混合后的溶液呈酸性,则发生的反应是 | |
| [ ] | |
A. |
强碱和弱酸溶液之间的反应 |
B. |
强碱和强酸溶液之间的反应 |
C. |
较浓酸溶液和较稀碱溶液之间的反应 |
D. |
多元强酸和一元强碱之间的反应 |
 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。
(2)氯化铝水溶液呈_______,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______________;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_________。
(3) 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
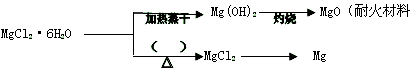
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)
 Mg2++2OH-。向体系中加入(请填出两种不同类别的物质________________________有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质________________________有利于Mg(OH)2溶解。 ③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,某温度 时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性 ,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3) 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
![]()
![]()
![]()
![]()
![]() Mg(OH)2 MgO(耐火材料)
Mg(OH)2 MgO(耐火材料)
![]()
![]() MgCl2·6H2O
MgCl2·6H2O
![]()
![]()
![]() MgCl2 Mg
MgCl2 Mg
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固) ![]() Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
查看习题详情和答案>>