摘要:(南京市2009届高三质量检测9月)锌是一种重要的金属.锌及其化合物有着广泛的应用. (1)葡萄糖酸锌[CH2OH(CHOH4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式 ,葡萄糖[CH2OH4CHO]分子中碳原子杂化方式是 . (2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子空间构型为 ,在[Zn(NH3)4]2+中.Zn2+位于正四面体中心.N位于正四面体的顶点.试在下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键 . (3)上右图表示锌与某种元素X形成的化合物晶胞.其中Zn和X通过共价键结合.该化合物的化学式为 ,该化合物的晶体熔点比干冰高得多.原因是 .
网址:http://m.1010jiajiao.com/timu3_id_415934[举报]
A.《物质结构与性质》
锌是一种重要的金属,锌及其化合物有着广泛的应用.

(1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子空间构型为
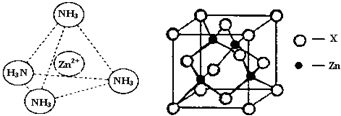
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键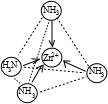
 .
.
(3)如图2表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
查看习题详情和答案>>
锌是一种重要的金属,锌及其化合物有着广泛的应用.

(1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
1s22s22p63s23p63d10
1s22s22p63s23p63d10
;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式sp2、sp3
sp2、sp3
.(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子空间构型为
三角锥型
三角锥型
;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键


(3)如图2表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
ZnX
ZnX
;该化合物的晶体熔点比干冰高得多,原因是该化合物是原子晶体,而干冰是分子晶体
该化合物是原子晶体,而干冰是分子晶体
.锌是一种重要的金属,锌及其化合物有着广泛的应用.
①指出锌在周期表中的位置:第
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于

④如图2表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
查看习题详情和答案>>
①指出锌在周期表中的位置:第
四
四
周期,第IIB
IIB
族,属于ds
ds
区.②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
1s22s22p63s23p63d10或[Ar]3d10
1s22s22p63s23p63d10或[Ar]3d10
;葡萄糖分子中碳原子杂化方式有sp2、sp3
sp2、sp3
.③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于
极性分子
极性分子
(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键.
④如图2表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
ZnX
ZnX
;该化合物晶体的熔点比干冰高
高
(填写“高”或“低”),原因是该化合物是原子晶体,而干冰是分子晶体
该化合物是原子晶体,而干冰是分子晶体
.(2010?启东市模拟)(1)CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用.
①指出锌在周期表中的位置:
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于
④如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
查看习题详情和答案>>
CDE
CDE
.A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用.
①指出锌在周期表中的位置:
四
四
周期,ⅡB
ⅡB
族,ds
ds
区.②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
1s22s22p63s23p63d10或[Ar]3d10
1s22s22p63s23p63d10或[Ar]3d10
;葡萄糖分子中碳原子杂化方式有sp2、sp3
sp2、sp3
.③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于
极性分子
极性分子
(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键.④如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
ZnX
ZnX
;该化合物的晶体熔点比干冰高得多,原因是高,该化合物是原子晶体,而干冰是分子晶体
高,该化合物是原子晶体,而干冰是分子晶体
.
(1)CH3+、-CH3、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个-CH3或一个CH3+和一个CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用.
①指出锌在周期表中的位置:第
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.葡萄糖分子中碳原子杂化方式有
查看习题详情和答案>>
CDE
CDE
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个-CH3或一个CH3+和一个CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用.
①指出锌在周期表中的位置:第
四
四
周期,第IIB
IIB
族,属于ds
ds
区.②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.葡萄糖分子中碳原子杂化方式有
sp2、sp3
sp2、sp3
;写出基态Zn原子的电子排布式1s22s22p63s23p63d104s2
1s22s22p63s23p63d104s2
.(1) 、—CH3、
、—CH3、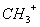 都是重要的有机反应中间体,有关它们的说法正确的是_________________
都是重要的有机反应中间体,有关它们的说法正确的是_________________
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.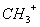 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3或一个 和一个
和一个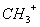 结合均可得到CH3CH3
结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置:第________周期,第________族,属于________区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。葡萄糖分子中碳原子杂化方式有___________;写出基态Zn原子的电子排布式___________________。
查看习题详情和答案>>